题目内容
【题目】氮、磷、硫、氯的化合物种类繁多,应用广泛。
(1)工业中可用POF3合成杀虫农药,组成该物质的三种元素的电负性由大到小的顺序是______。
(2)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质存在的化学键有离子键、共价键和_____。
(3)KCN可被H2O2氧化为KOCN
①KOCN可作为制药原料,其晶体类型是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为____。
②H2O2常温下是液体,沸点较高(150℃),其主要原因是____。
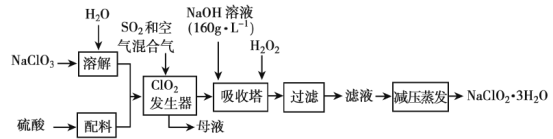
(4)SO3和O3的混合气体经光解作用,可生成一种结构如图所示的物质,该物质中S原子的轨道杂化方式是____,该分子属于___(填“极性分子”或“非极性分子”)。

【答案】F、O、P 配位键 2NA H2O2分子之间存在氢键 sp3杂化 极性
【解析】
(1)根据非金属性越强电负性越强判断;
(2)铁是26号元素,根据构造原理写出亚铁离子核外电子排布式,中心原子有空轨道,配离子含有孤对电子,据此判断;
(3)①根据C形成的共价键数和杂化类型分析判断;②H2O2分子之间存在氢键,据此解答;
(4)由图可知S形成了4个共价键,即含有4个价层电子对,空间结构不对称,据此分析判断。
(1)非金属性越强,电负性越强,非金属性F>O>P,所以电负性由大到小的顺序是F、O、P,故答案为:F、O、P;
(2)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar]3d6,当中心原子有空轨道,配离子含有孤对电子时,能形成配位键;非金属原子间能形成共价键,所以KFe[Fe(CN)6]含有离子键、共价键、配位键,故答案为:配位键;
(3)①KOCN是由活泼金属和活泼非金属构成的,属于离子晶体,C能形成4个共价键,已知其杂化方式为sp杂化,说明含有2个δ键即有2个价层电子对,另外的2个共价键为π键,所以1mol该物质中含有的π键数目为2NA,故答案为:2NA;
②H2O2分子之间存在氢键,使其沸点较高,故答案为:H2O2分子之间存在氢键;
(4)由图可知S形成了4个共价键,即含有4个价层电子对,所以S原子的轨道杂化方式是sp3杂化;由于分子的空间结构不对称,因此该分子是极性分子,故答案为:sp3杂化;极性。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案