题目内容
1.两同学为制得纯净的Fe(OH)2,使用如图所示的装置,A管中是Fe和H2SO4,B管中是NaOH溶液: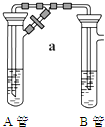
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是有白色沉淀生成,迅速变成灰绿色,最终变成红褐色.
(2)同学乙:先打开a,使A管中反应一段时间后再夹紧止水夹a,
实验中在B管中观察到的现象是有白色沉淀生成.
B中发生反应的离子方程式为Fe2++2OH-=Fe(OH)2↓.
分析 (1)Fe和稀硫酸反应生成氢气和硫酸亚铁,生成的氢气导致溶液通过导管进入B装置,氢氧化钠和硫酸亚铁反应生成氢氧化亚铁,Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3;
(2)Fe和稀硫酸反应生成氢气和硫酸亚铁,生成的氢气将空气排出,防止生成的白色沉淀氢氧化亚铁被氧化.
解答 解:(1)A中反应为Fe+H2SO4=FeSO4+H2↑,氢气的生成导致A中压强增大,溶液从导管进入B试管,B中反应为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,Fe(OH)2不稳定易被空气氧化生成 Fe(OH)3,所以现象是有白色沉淀生成,迅速变成灰绿色,最终变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:有白色沉淀生成,迅速变成灰绿色,最终变成红褐色;
(2)先打开止水夹a,使A管中物质反应一段时间后,再夹紧止水夹,A中生成的氢气将空气排出,生成的硫酸亚铁和氢氧化钠混合时氢氧化亚铁不被氧化,所以看到的现象是有白色沉淀生成(且不变色),B中发生反应的离子方程式为:Fe2++2OH-=Fe(OH)2↓,
故答案为:有白色沉淀生成,Fe2++2OH-=Fe(OH)2↓.
点评 本题考查了氢氧化亚铁的制备,题目难度中等,氢氧化亚铁不稳定,易被空气氧化生成氢氧化铁而变质,为制取氢氧化亚铁,需要将空气隔绝,只要不存在氧气就能制得较纯净的氢氧化亚铁,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
10.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | “地沟油”可以制成肥皂,从而提高资源的利用率 |
14.下列说法正确的是( )
| A. | 1.5g-CH3中含有的电子数为6.02×1023 | |
| B. | 标准状况下.22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 | |
| C. | 工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上溶解的铜原子数必为0.5×6.02×1023 | |
| D. | VL amo1•L-1氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023. |
13. 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
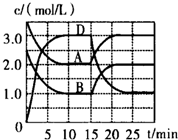 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |
11.据最新报道:用10B合成的10B20分子有非常好的抗癌作用.下列说法正确的是( )
| A. | 10B的质子数是10 | B. | 10B的中子数与核外电子数不同 | ||
| C. | 10B20是一种新合成的化合物 | D. | 10B20具有较强的化学活性 |
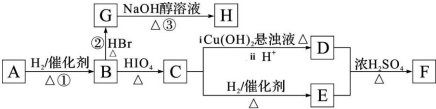
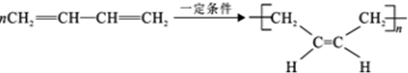 .若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
.若H 分子中所有碳原子均在一条直线上,则G 转化为H 的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
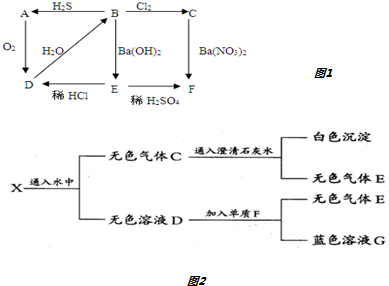
. 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]