题目内容
(10分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
(5)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为 3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;
(1)3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O (2)16 g
(3)0.1 mol (4)0.05<n<0.15 (5)43.2
【解析】
试题分析:(1)Cu2O跟稀硝酸发生氧化还原反应,反应的离子方程式是3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O;(2)根据元素守恒,硝酸中的N元素在反应后的才知形式是以Cu(NO3)2和NO,n(HNO3)= 2n(Cu(NO3)2)+n(NO),0.6=2n(Cu(NO3)2)+0.1mol,所以n(Cu(NO3)2)=0.25mol,所以根据Cu元素守恒,若将上述混合物用足量的H2加热还原,所得到固体的质量为m(Cu)= 0.25mol×64g/mol=16g。(3)设Cu2O的物质的量为m,CuO的物质的量为n,所以由得失电子守恒可得0.1mol×2+2m=0.1mol×3,解得m=0.05 mol,由铜原子守恒可得n=0.05 mol,则根据Cu2O+H2SO4=CuSO4+Cu+H2O和CuO+H2SO4=CuSO4+H2O可知,消耗稀硫酸的物质的量是0.1mol;(4)由(2)知铜元素的总的物质的量为0.25 mol,设Cu2O、CuO的物质的量分别为x和y,则由得失电子守恒得2n+2x=0.1mol×3,解得 ;由铜原子守恒得n+2x+y=0.25mol,所以y=(n-0.05)mol。因Cu2O、CuO的物质的量均大于零,所以可得n的范围为0.05 mol<n<0.15 mol。(5)根据题意可得方程式:N2H4+ 4Cu(OH)2
;由铜原子守恒得n+2x+y=0.25mol,所以y=(n-0.05)mol。因Cu2O、CuO的物质的量均大于零,所以可得n的范围为0.05 mol<n<0.15 mol。(5)根据题意可得方程式:N2H4+ 4Cu(OH)2  2Cu2O +N2+ 6H2O。n(N2)=3.36L÷22.4L/mol=0.15 mol,则根据方程式中Cu2O与N2的物质的量关系可得n(Cu2O)=0.30mol,m(Cu2O)= 0.30mol×144g/mol=43.2g.
2Cu2O +N2+ 6H2O。n(N2)=3.36L÷22.4L/mol=0.15 mol,则根据方程式中Cu2O与N2的物质的量关系可得n(Cu2O)=0.30mol,m(Cu2O)= 0.30mol×144g/mol=43.2g.
考点:考查守恒法氧化还原反应的计算的知识。

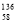 Ce、
Ce、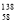 Ce、
Ce、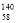 Ce、
Ce、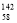 Ce,它们互为同素异形体
Ce,它们互为同素异形体