题目内容
环保检测中,有害气体的浓度常用1L有害气体的毫克值(mg·L-1)来表示.如对某气体样品中所含一氧化碳的浓度进行测定,其方法和实验步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2.
②用30.0mL 5.00×10-3mol·L-1的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:I2+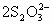 =2I-+
=2I-+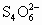 .
.
③将②中溶液取出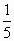 ,加入1.00mL 1.00×10-2mol·L-1碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化.
,加入1.00mL 1.00×10-2mol·L-1碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化.
(1)写出步骤①中CO通过盛I2O5加热管的有关反应化学方程式.
(2)计算样品中CO的浓度.
答案:
解析:
解析:
|
解:(1)5CO+I2O5 (2)n(I2)=1.00×10-3L×1.00×10-2mol·L-1=1.00×10-5mol. 设1.00×10-5mol I2消耗Na2S2O3物质的量为x, 由关系式2Na2S2O3 ~ I2 2 mol 1mol x 1.00×10-5mol x=2.00×10-5mol CO还原出的I2消耗Na2S2O3的物质的量为 30.0×10-3L×5.00×10-3mol·L-1-2.00×10-5mol×5 =5.00×10-5mol 设CO的物质的量为y, 由关系式: 2mol 5mol 5.00×10-5mol y 有y= 所以CO的浓度= =1.75mg·L-1 答:略. |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 I2+5CO2
I2+5CO2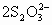 ~ 5CO
~ 5CO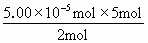 =1.25×10-4mol
=1.25×10-4mol