题目内容
3.已知实验室制取氯气的反应为:MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O,取10.44g二氧化锰跟100mL12mol/L浓盐酸充分反应,求:(1)在标准状况下生成多少升Cl2?
(2)发生氧化反应的HCl的物质的量是多少?
(3)向反应后的溶液中加入过量的AgNO3溶液,则能生成多少克白色沉淀?
分析 (1)根据n=$\frac{m}{M}$计算出二氧化锰的物质的量,再根据n=cV计算出100mL12mol/L浓盐酸中含有HCl的物质的量,结合反应方程式判断过量情况,根据不足量计算出生成氯气的物质的量,最后根据V=nVm计算出生成氯气在标准状况下的体积;
(2)HCl被氧化生成氯气,根据氯气的物质的量及Cl盐酸守恒计算出发生氧化反应的HCl的物质的量;
(3)加入过量硝酸银溶液反应生成AgCl沉淀,根据Cl元素守恒可计算出生成氯化银的物质的量,然后根据m=nM计算出生成氯化银的质量.
解答 解:(1)10.44g二氧化锰的物质的量为:$\frac{10.44g}{87g/mol}$=0.12mol,100mL12mol/L浓盐酸中含有HCl的物质的量为:12mol/L×0.1L=1.2mol,
根据反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,0.12mol二氧化锰完全反应消耗HCl的物质的量为:0.12mol×4=0.48mol<1.2mol,说明浓盐酸过量,生成的氯气按照二氧化锰的量计算,
MnO2+4HCl(浓)→MnCl2+Cl2↑+2H2O
1 1
0.12mol n(Cl2)
则生成氯气的物质的量为0.12mol,标准状况下0.12mol氯气的体积为:22.4L/mol×0.12mol=2.688L,
答:在标准状况下生成2.688LCl2;
(2)反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中HCl被氧化生成氯气,根据Cl元素守恒可知发生氧化反应的HCl的物质的量为:n(HCl)=2n(Cl2)=0.12mol×
2=0.24mol,
答:发生氧化反应的HCl的物质的量为0.24mol;
(3)100mL12mol/L浓盐酸中含有HCl的物质的量为1.2mol,被氧化生成氯气的HCl的物质的量为0.24mol,则反应后溶液中含有氯离子的物质的量为:1.2mol-0.24mol=0.96mol,
根据Cl元素守恒可知生成AgCl的物质的量为0.96mol,质量为:143.5g/mol×0.96mol=137.76g,
答:向反应后的溶液中加入过量的AgNO3溶液,则能生成137.76g AgCl白色沉淀.
点评 本题考查了氧化还原反应计算,题目难度中等,明确氧化还原反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案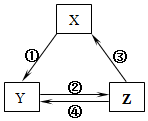 表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )
表所列各组物质中,物质之间通过一步反应就能实现如图所示转化且所给反应条件正确的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | SiO2 | Na2SiO3 | H2SiO3 | ①与Na2CO3熔融 |
| B | Na | Na2O2 | NaCl | ②加H2O |
| C | NO | NO2 | HNO3 | ③与C加热 |
| D | Al2O3 | NaAlO2 | Al(OH)3 | ④与NaOH |
| A. | A | B. | B | C. | C | D. | D |
| A. | Cu(OH)2难溶于水,属于非电解质 | |
| B. | Al2O3既能与强碱反应生成盐和水又能与酸反应生成盐和水,属于两性氧化物 | |
| C. | NH4Cl组成中不含金属离子,不属于盐 | |
| D. | HCl气体溶于水电离出H+和Cl-,属于离子化合物 |
| A. | O2、O3是同一种单质 | |
| B. | 1H、2H、3H、H+、H2是氢元素形成的五种不同粒子 | |
| C. | 正丁烷和异丁烷互为同系物 | |
| D. | 乙醇、乙醚互为同分异构体 |
| A. | Fe2O3失电子 | B. | Al被还原 | ||
| C. | Fe2O3发生氧化反应 | D. | 每消耗27g铝转移3mol电子 |
| A. | 青铜是我国用量最大、用途最广的合金 | |
| B. | FeCl3腐蚀Cu刻制印刷电路板 | |
| C. | 硅胶可用作食品干燥剂 | |
| D. | SO2可用于漂白纸浆 |
 .
.