题目内容
12.Al、Fe、Cu是生活中常见的金属,也是应用最广泛的金属.请回答下列问题: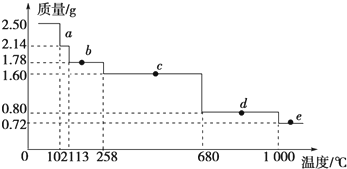
(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式NaAlO2
向反应后的溶液中通入过量CO2,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(2)铁的复杂氧化物Fe3O4溶于稀硫酸生成两种盐,则反应的化学方程式为Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
检验反应后的溶液中存在Fe2+的具体操作是取少量溶液于试管中,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则反应后的溶液中存在Fe2+;
纳米级Fe3O4是一种吸附剂,在溶液中可发生如下反应:Fe3O4+H2O+O2→Fe(OH)3,每转移1mol电子生成Fe(OH)3的物质的量为3mol.
(3)2.50g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
请回答下列问题:
Ⅰ.试确定b点时固体物质的化学式CuSO4•H2O(要求写出必要的推理过程);
Ⅱ.取270℃所得样品,于770℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为CuSO4$\frac{\underline{\;770℃\;}}{\;}$CuO+SO3↑.把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为CuSO4•5H2O.
Ⅲ.1000℃发生反应的化学方程式为CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑.
分析 (1)铝、氧化铝、氢氧化铝当与氢氧化钠溶液反应生成偏铝酸钠;偏铝酸钠与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠;
(2)Fe3O4的氧化物的写成FeO•Fe2O3,则四氧化三铁与稀硫酸反应生成硫酸铁和硫酸亚铁,据此写出反应的化学方程式;铁离子和亚铁离子同时存在时,具有亚铁离子需要用酸性高锰酸钾溶液;根据电子守恒计算出转移1mol电子生成氢氧化铁的物质的量;
(3)Ⅰ.(1)CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,113~258℃时失去的水的质量为2.50g-1.78g=0.72g,根据反应的化学方程式计算失去水n值;
Ⅱ.根据产物性质及图象水解判断770℃时的反应产物,然后形成反应的化学方程式;氧化铜与稀硫酸反应生成硫酸铜,经浓缩、冷却析出的晶体为CuSO4•5H2O;
Ⅲ.根据Ⅱ可知1000℃后CuO加热分解,根据质量变化判断产物,然后写出方程式.
解答 解:(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应中都生成了NaAlO2,所以得到的溶液中溶质为偏铝酸钠;偏铝酸钠与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:NaAlO2;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(2)Fe3O4的氧化物的表示形式可以写成FeO•Fe2O3,稀硫酸与四氧化三铁反应生成硫酸亚铁和硫酸铁,反应的化学方程式为:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O;
由于溶液中含有铁离子和亚铁离子,则检验亚铁离子选用酸性高锰酸钾溶液,方法为:取少量溶液于试管中,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则反应后的溶液中存在Fe2+;
Fe3O4中铁元素的化合价为+$\frac{8}{3}$价,氢氧化铁中铁元素的化合价为+3价,则生成1mol氢氧化铁转移的电子为:(3-$\frac{8}{3}$)mol=$\frac{1}{3}$mol,则转移1mol电子生成氢氧化铁的物质的量为:$\frac{1mol}{\frac{1}{3}mol}$mol=3mol,
故答案为:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O; 取少量溶液于试管中,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则反应后的溶液中存在Fe2+; 3mol;
(3)Ⅰ.CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解,113~258℃时失去的水的质量为2.50g-1.78g=0.72g,根据反应的化学方程式可知:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
2.50g 2.50g-1.78g=0.72g,
解的:n=4
113~258℃时固体b的化学式为CuSO4•H2O,
故答案为:CuSO4•H2O;
Ⅱ.2.5gCuSO4•5H2O的物质的量为:$\frac{2.5g}{250g/mol}$=0.01mol,完全失去结晶水后的质量为:160g/mol×0.01mol,则258℃~680℃时为CuSO4,温度升高到680℃后硫酸铜分解生成黑色的氧化铜和三氧化硫,反应方程式为:CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$CuO+SO3↑;CuO与稀硫酸反应的产物是硫酸铜和水,蒸发浓缩、冷却得到的晶体为CuSO4•5H2O,
故答案为:CuSO4$\frac{\underline{\;770℃\;}}{\;}$CuO+SO3↑;CuSO4•5H2O;
Ⅲ.1000℃时氧化铜在加热条件下发生分解,根据图象可知,0.80g氧化铜加热后变为0.72g,0.80gCuO的物质的量为:$\frac{0.80g}{80g/mol}$=0.01mol,含有铜的质量为:64g/mol×0.01mol=0.64g,则0.72g固体中含有的氧元素的质量为:0.72g-0.64g=0.08g,含有氧元素的物质的量为:$\frac{0.08g}{16g/mol}$=0.005mol,则该产物的化学式为:Cu2O,根据化合价变化可知另一种产物为氧气,则该反应的化学方程式为:CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑,
故答案为:CuO$\frac{\underline{\;1000℃\;}}{\;}$2Cu2O+O2↑.
点评 本题考查了常见金属单质及其化合物性质的综合应用,题目难度中等,明确常见金属单质及其化合物性质为解答关键,试题涉及的知识点较多,综合性较强,充分考查了学生的分析、理解能力及化学计算能力.

| A. |  三脚架 | B. |  蒸发皿 | C. |  坩埚钳 | D. |  泥三角 |
| A. | 只能为2 | B. | 只能为3 | ||
| C. | 可能为2,也可能为3 | D. | 无法确定 |
| A. | 标准状况下,22.4L由NO2和NO组成的混合气体中含有的氧原子数目为2NA | |
| B. | 常温常压下,含34gH2O2的溶液中氢原子的物质的量为2moI | |
| C. | 高温下,16.8gFe与足量水蒸气完全反应,失去0.8NA个电子 | |
| D. | 常温下,100mLlmol.L-l盐酸与4.6 g钠反应生成0.05 molH2 |
| A. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应 | |
| B. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝 | |
| C. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| D. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水有漂白性 |
| A. | 在光照条件下,甲烷与氯水发生取代反应 | |
| B. | 有机反应中,卤代、硝化、磺化、酯化、水解反应等不完全是取代反应 | |
| C. | 乙醇可与水以任意比例混溶,是因为与水形成了氢键 | |
| D. | 若烃中碳、氢元素的质量分数相同.它们必定是同系物 |
| A. | 标准状况下,22.4L H2O含有的分子数等于0.1NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 常温常压下,1 mol 甲烷分子中所含质子数为10NA | |
| D. | 标准状况下,22.4L乙醇的分子数为NA |
 在一个小烧杯里,加入 40g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有4~5滴水的玻璃片上.然后加入20g NH4Cl晶体,并用玻璃棒迅速搅拌.如图所示.回答下列问题:
在一个小烧杯里,加入 40g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有4~5滴水的玻璃片上.然后加入20g NH4Cl晶体,并用玻璃棒迅速搅拌.如图所示.回答下列问题: