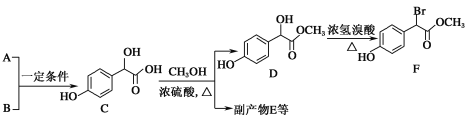
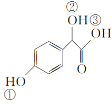
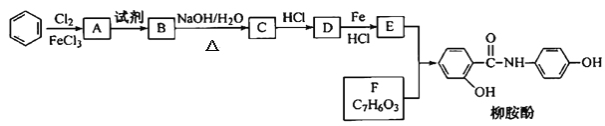
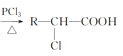题目内容
【题目】碳酸钠是重要的化工原料之一,广泛应用于轻工日化、建材、食品工业等行业。
(1)市售碳酸钠中含有氯化钠杂质,选用下列试剂设计实验方案进行检验,试剂:稀H2 SO4、BaCl2溶液、Ca(NO3)2溶液、AgNO3溶液
实验步骤 | 现 象 |
①取少量样品,加蒸馏水溶解 | ②固体完全溶解得到无色澄清溶液 |
③_____ | ④有白色沉淀生成 |
⑤静置,________ | ⑥ ________ |
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用____加蒸馏水至刻度线。
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用____取500 mL水并倒入烧杯中,搅拌摇匀后,转入____色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L。
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,滴定终点的现象为_________。
重复上述操作三次。四次测定数据如下表:
实验序号 | 1 | 2 | 3 | 4 |
消耗AgNO3溶液体积/mL | 20.00 | 21. 55 | 20. 02 | 19. 98 |
若在滴定终点读取滴定管刻度时俯视标准液液面,则测定结果____(填“偏高”、“偏低”或“无影响”);样品的纯度为____%。
【答案】加入过量 Ca(NO3)2溶液 取上层清液, 滴入AgNO3溶液 有白色沉淀生成 胶头滴管 量筒 棕 滴入最后一滴 AgNO3 标准溶液, 出现砖红色沉淀, 且半分钟内颜色不复原 偏高 ![]()
【解析】
(1)市售碳酸钠中含有氯化钠杂质,要检验氯化钠杂质可以检验是否含有氯离子即可,检验之前需要先排除碳酸根离子的干扰,据此分析解答;
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。滴定过程的原理为Ag++Cl-=AgCl↓,当溶液中的氯离子滴定结束时,硝酸银和K2CrO4会反应生成砖红色的Ag2CrO4沉淀,据此分析解答。
(1)市售碳酸钠中含有氯化钠杂质,要检验氯化钠杂质可以检验是否含有氯离子即可,检验之前需要先排除碳酸根离子的干扰,实验方案为:取少量样品,加蒸馏水溶解,固体完全溶解得到无色澄清溶液;加入过量 Ca(NO3)2溶液,有白色碳酸钙沉淀生成;取上层清液, 滴入AgNO3溶液,有白色氯化银沉淀生成,故答案为:加入过量 Ca(NO3)2溶液;取上层清液, 滴入AgNO3溶液;有白色沉淀生成;
(2)用AgNO3标准溶液滴定Cl-(以K2CrO4溶液为指示剂,Ag2CrO4为砖红色沉淀),来测定碳酸钠的纯度。
①配制样品溶液:称取某碳酸钠样品mg,用容量瓶配制100 mL溶液,定容时,用胶头滴管加蒸馏水至刻度线,故答案为:胶头滴管;
②配制AgNO3溶液及浓度标定:称取AgNO3晶体8.5 g于烧杯中,用量筒取500 mL水并倒入烧杯中,AgNO3见光容易分解,搅拌摇匀后,转入棕色试剂瓶,置于暗处、备用。用NaCl标准溶液标定上述AgNO3溶液浓度为b mol/L,故答案为:量筒;棕;
③滴定样品:取样品溶液20. 00 mL于锥形瓶中,加过量稀HNO3,滴入2~3滴K2 CrO4溶液,用AgNO3标准溶液滴定,氯化银为白色沉淀,Ag2CrO4为砖红色沉淀,因此滴定终点的现象为滴入最后一滴 AgNO3 标准溶液, 出现砖红色沉淀, 且半分钟内颜色不复原;根据四次测定数据,第2次的实验数据偏差较大,删除,其余3次实验数据的平均值为![]() =20.00 mL,滴定过程的原理为Ag++Cl-=AgCl↓,消耗AgNO3的物质的量=0.02L×b mol/L=0.02bmol,则原溶液中氯离子的物质的量=0.02bmol×
=20.00 mL,滴定过程的原理为Ag++Cl-=AgCl↓,消耗AgNO3的物质的量=0.02L×b mol/L=0.02bmol,则原溶液中氯离子的物质的量=0.02bmol×![]() =0.1bmol,样品中氯化钠的含量为
=0.1bmol,样品中氯化钠的含量为![]() ×100%=
×100%=![]() %,则样品的纯度为1-
%,则样品的纯度为1-![]() %=
%=![]() %,若在滴定终点读取滴定管刻度时俯视标准液液面,会导致读取的AgNO3溶液体积偏小,测得的样品中氯化钠的含量偏低,样品的纯度偏高,故答案为:滴入最后一滴 AgNO3 标准溶液, 出现砖红色沉淀, 且半分钟内颜色不复原;偏高;
%,若在滴定终点读取滴定管刻度时俯视标准液液面,会导致读取的AgNO3溶液体积偏小,测得的样品中氯化钠的含量偏低,样品的纯度偏高,故答案为:滴入最后一滴 AgNO3 标准溶液, 出现砖红色沉淀, 且半分钟内颜色不复原;偏高;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ、已知:SiHCl3在催化剂作用下可发生如下反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48kJ·mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=30kJ·mol1
(1)写出由SiHCl3(g)分解产生SiH4(g)和SiCl4(g)的热化学方程式为__。
Ⅱ、298K时,溶液中存在如下反应:A(aq)![]() B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
t/min | 0 | 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
c/(mol·L-1) | 0 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
回答下列问题:
(2)该反应在50~80min内的平均反应速率为__mol·L1·min1。
(3)120min时A的转化率为__。
(4)298K时,该反应的平衡常数K=__,升温时平衡常数__(填“增大”、“减小”、或“不变”)。
(5)为提高A的平衡转化率,除适当控制反应温度外,还可采取的措施是__。
(6)下列叙述可说明可逆反应已达平衡的是__。
A.c(A)=c(B)
B.A和B反应速率相等
C.A和B的物质的量比值保持恒定
D.溶液的总质量保持恒定