题目内容
20. 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g);△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g);△H2=+172.5kJ•mol-1.则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
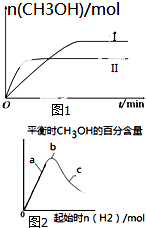
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得CH3OH的物质的量随时间的变化如图1所示,请回答下列问题:
①该反应的平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$.
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ大于_KⅡ(填“大于”、“等于”或“小于”).
③在如图2a、b、c三点中,H2的转化率由高到低的顺序是a>b>c(填字母).
(3)在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是bc.
a.氢气的浓度减小
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(4)在恒温恒容条件下,起始加入的反应物不变,要增大CH3OH 的产率,可以采取的有效措施是
增大压强.
分析 (1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3计算;
(2)①平衡常数表达式K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,温度越高,化学平衡常数越小;
③增加氢气的量平衡正向移动,但氢气的转化率越来越小;
(3)增大压强,正、逆反应速率都增大,平衡向正反应方向,平衡时各组分的浓度都增大,据此判断;
(4)起始加入的反应物不变,要增大CH3OH 的产率,即通过改变温度或者压强使平衡正向移动,据此判断.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
由盖斯定律①-②×3得到Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1,故答案为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)可知,K=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$,故答案为:$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$;
②II平衡时间小于I,说明II反应速率大于I,且平衡时II中CH3OH的物质的量小于I,说明平衡向逆反应方向移动,则只能是升高温度,即II的温度大于I,温度越高,平衡向逆反应方向移动,导致化学平衡常数越小,所以KⅠ>KⅡ,故答案为:大于;
③增加氢气的量平衡正向移动,但氢气的转化率越来越小,所以H2的转化率由高到低的顺序是a>b>c,故答案为:a>b>c;
(3)a.增大压强,平衡时氢气的浓度增大,故a错误;
b.增大压强,反应物、生成物的浓度都增大,故正、逆反应速率都加快,故b正确;
c.增大压强平衡向正反应方向移动,甲醇的物质的量增加,故c正确;
d.增大压强平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡时$\frac{n(H{\;}_{2})}{n(CH{\;}_{3}OH)}$减小,故d错误,
故答案为:bc;
(4)起始加入的反应物不变,要增大CH3OH 的产率,即通过降低温度或者增大压强使平衡正向移动,又恒温恒容条件下,所以只能增大压强,故答案为:增大压强.
点评 本题综合性较大,涉及盖斯定律的应用、化学平衡常数、化学平衡影响因素等,题目难度中等.

| A. | 向溶液中加入适量氯化铵固体 | |
| B. | 向溶液中加入一定体积的pH=4的盐酸 | |
| C. | 向溶液中加水至溶液体积为1000mL | |
| D. | 向溶液中加入适量醋酸钠固体 |
(1)请填写表格的空白处:
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
(3)③与⑨发生反应的离子方程式为CaO+2H+=Ca2++H2O.
(4)⑦⑧两种试剂可以采用多种方法鉴别,请写出其中一种方法用光束照射,能够发生丁达尔效应的是淀粉溶液,余者为硫酸钠溶液.
| A. | 用丁达尔效应鉴别氢氧化铁胶体和稀豆浆 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用加热方法可以除去MgCl2中的NH4HCO3 |
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO${\;}_{3}^{2-}$+2H+═CO2↑十H2O BaCO3+2HCl═BaCl2+C02↑十H20 | |
| C. | Ca2++CO${\;}_{3}^{2-}$═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H20 CH3COOH+KOH=CH3COOK+H20 |
| A. | 大于50% | B. | 小于50% | C. | 等于50% | D. | 不能确定 |


 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基 .
.