题目内容
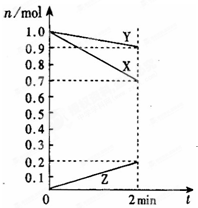 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的 量随时间变化曲线如图所示.由图中数据分析,该反应的 化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的 量随时间变化曲线如图所示.由图中数据分析,该反应的 化学方程式为:(2)取a mol A和b mol B置于V L容器中,发生可逆反应:aA(g)+bB(g)?cC(g)+dD(g),1min后,
测得容器内A的浓度为x mol?L-1,这时B的浓度为:
分析:(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比确定化学计量,据此书写方程式;
根据根据v=
计算反应速率v(Z);
(2)计算A的浓度变化量,利用浓度变化量之比等于化学计量数之比计算△c(B)、△c(C),1min是B的浓度为B的起始浓度-△c(B);
根据v=
计算反应速率v(A).
根据根据v=
| △c |
| △t |
(2)计算A的浓度变化量,利用浓度变化量之比等于化学计量数之比计算△c(B)、△c(C),1min是B的浓度为B的起始浓度-△c(B);
根据v=
| △c |
| △t |
解答:解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,反应开始至2min,Z的平均反应速率为v(Z)=
=0.05mol/(L?min),
故答案为:3X+Y?2Z;0.05mol/(L?min);
(2)在2min时间内,用Z表示反应的平均速率v(Z)═0.05mol/(L?min),
用Y表示的平均反应速率为v(Y)=×0.05mol/(L?min)=0.025mol/(L?min);
故答案为:0.05mol/?(L?min);0.025mol/(L?min)
(2)测得容器内A的浓度为x mol?L-1,则△c(A)=
-x mol/L=(
-x)mol/L,则△c(B)=
×(
-x)mol/L=(
-
)mol/L,故1min是B的浓度为
-(
-
)mol/L=
mol/L;
1min时△c(C)=
△c(A)=
×(
-x)mol/L=(
-
)mol/L,
这段时间内反应速率若以物质A的浓度变化来表示,则v(A)=
=(
-x)mol/(L.min),
故答案为:
mol/L;(
-
)mol/L;(
-x)mol/(L.min).
| ||
| 2min |
故答案为:3X+Y?2Z;0.05mol/(L?min);
(2)在2min时间内,用Z表示反应的平均速率v(Z)═0.05mol/(L?min),
用Y表示的平均反应速率为v(Y)=×0.05mol/(L?min)=0.025mol/(L?min);
故答案为:0.05mol/?(L?min);0.025mol/(L?min)
(2)测得容器内A的浓度为x mol?L-1,则△c(A)=
| amol |
| VL |
| a |
| V |
| b |
| a |
| a |
| V |
| b |
| V |
| bx |
| a |
| bmol |
| VL |
| b |
| V |
| bx |
| a |
| bx |
| a |
1min时△c(C)=
| c |
| a |
| c |
| a |
| a |
| V |
| c |
| V |
| cx |
| a |
这段时间内反应速率若以物质A的浓度变化来表示,则v(A)=
(
| ||
| 1min |
| a |
| V |
故答案为:
| bx |
| a |
| c |
| V |
| cx |
| a |
| a |
| V |
点评:本题考查化学平衡图象、化学平衡计算、反应速率计算等,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法.

练习册系列答案
相关题目
(10分)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
?1?根据下表中数据,在下图中画出X、Y、Z的物质的量n随时间t变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

?2?体系中发生反应的化学方程式是_____________;
?3?列式计算该反应在0~3 min时间内产物Z的平均反应速率:______________________;
?4?该反应达到平衡时反应物X的转化率α等于________;
?5?如果该反应是放热反应。在该反应达到上述平衡状态时改变实验条件?温度、压强、催化剂?得到Z的物质的量(mol)随时间t(min)变化的曲线1、2、3?如上右图所示?则曲线1、2、3所对应的实验条件改变分别是:1______________,2______________,3______________。

 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示.由图中数据分析,该反应的化学方程式为: (1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为
(1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为 2Z
2Z