题目内容
 (1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为
(1)某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.①由图中所给数据进行分析,该反应的化学方程式为3X+Y 2Z
2Z
 2Z
2Z3X+Y 2Z
2Z
; 2Z
2Z②反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=
0.05mol/(l.min)
0.05mol/(l.min)
,③当反应进行了3min,该反应是否达到平衡
是
是
(填“是”或“否”).(2)把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现H2生成的速率变化情况如图,其中T1~T2速率变化的主要原因是
反应放热溶液温度升高反应速率增大
反应放热溶液温度升高反应速率增大
,T2~T3速率变化的主要原因是
溶液中H+的浓度逐渐减小反应速率减小
溶液中H+的浓度逐渐减小反应速率减小
.分析:(1)①根据参加反应的物质的物质的量之比等于化学计量数之比书写化学方程式;
②根据v=
计算;
③从曲线的变化特点分析;
(2)金属镁与酸的反应为放热反应,从曲线的变化判断影响反应速率的因素.
②根据v=
| △c |
| △t |
③从曲线的变化特点分析;
(2)金属镁与酸的反应为放热反应,从曲线的变化判断影响反应速率的因素.
解答:解:(1)①由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,
当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,
则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:3X+Y 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y 2Z;
2Z;
②反应开始至2min末,Z的反应速率为:v=
=
=0.05mol/(L?min),
故答案为:0.05mol/(L?min);
③3min后,各物质的物质的量不再发生变化,说明反应达到平衡状态,故答案为:是;
(2)金属镁与酸的反应为放热反应,反应开始时,温度不断升高,则反应速率逐渐增大,但随着反应的极性,反应物的浓度逐渐降低,此时浓度的影响大于温度的影响,反应速率反而减小,
故答案为:反应放热溶液温度升高反应速率增大;溶液中H+的浓度逐渐减小反应速率减小.
当反应进行到2min时,△n(X)=0.3mol,△n(Y)=0.1mol,△n(Z)=0.2mol,
则△n(X):△n(Y):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,
则反应的方程式为:3X+Y
 2Z,故答案为:3X+Y
2Z,故答案为:3X+Y 2Z;
2Z;②反应开始至2min末,Z的反应速率为:v=
| △c |
| △t |
| ||
| 2min |
故答案为:0.05mol/(L?min);
③3min后,各物质的物质的量不再发生变化,说明反应达到平衡状态,故答案为:是;
(2)金属镁与酸的反应为放热反应,反应开始时,温度不断升高,则反应速率逐渐增大,但随着反应的极性,反应物的浓度逐渐降低,此时浓度的影响大于温度的影响,反应速率反而减小,
故答案为:反应放热溶液温度升高反应速率增大;溶液中H+的浓度逐渐减小反应速率减小.
点评:本体靠考查化学平衡图象题和反应速率图象题目,题目难度不大,注意(2)为易错点,把握影响反应速率的因素.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案
相关题目
(10分)某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
?1?根据下表中数据,在下图中画出X、Y、Z的物质的量n随时间t变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

?2?体系中发生反应的化学方程式是_____________;
?3?列式计算该反应在0~3 min时间内产物Z的平均反应速率:______________________;
?4?该反应达到平衡时反应物X的转化率α等于________;
?5?如果该反应是放热反应。在该反应达到上述平衡状态时改变实验条件?温度、压强、催化剂?得到Z的物质的量(mol)随时间t(min)变化的曲线1、2、3?如上右图所示?则曲线1、2、3所对应的实验条件改变分别是:1______________,2______________,3______________。

 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示.由图中数据分析,该反应的化学方程式为: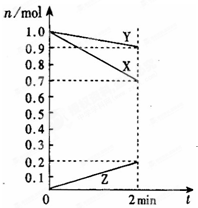 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的 量随时间变化曲线如图所示.由图中数据分析,该反应的 化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的 量随时间变化曲线如图所示.由图中数据分析,该反应的 化学方程式为: