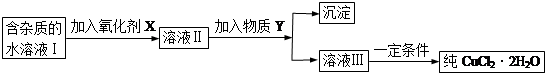题目内容
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略):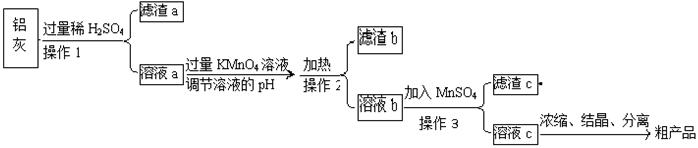
(1)滤渣a可用于制造 。
(2)请将MnO4-氧化Fe2+的离子方程式补充完整:
若反应中转移了2mol电子,则消耗氧化剂的物质的量为 mol。
(3)已知生成氢氧化物沉淀的pH如下:
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
调节溶液pH约为3的目的是: 。
(4)取少量滤渣C于试管中,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣C的主要成分是 。请写出加入MnSO4时所发生反应的离子方程式: 。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性的原因: 。(用离子方程式表示)
(1)光导纤维 (2分) (2)5、8 H+、5、4 H2O (2分);0.4mol(各2分)
(3)使溶液中的Fe3+完全沉淀(2分)
(4)MnO2(2分) 2 MnO4- +3Mn2+ +2H2O===5MnO2+4 H+(3分)
(5)Al3++3H2O Al(OH)3+3 H+(2分)
Al(OH)3+3 H+(2分)
解析试题分析:(1)铝灰中成分不与H2SO4反应的为SiO2,所以滤渣a为SiO2,可用于制造光导纤维。
(2)反应中MnO4-→Mn2+,Fe2+→Fe3+, MnO4-系数为1,根据电子转移守恒可知,Fe2+系数为 =5,由元素守恒可知, Fe3+系数为5,由电荷守恒可知,由H+参加反应,其系数为8,根据元素原子守恒可知,有H2O生成,其系数为4,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O。
=5,由元素守恒可知, Fe3+系数为5,由电荷守恒可知,由H+参加反应,其系数为8,根据元素原子守恒可知,有H2O生成,其系数为4,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O。
(3)滤液中含有Fe2+,由表中数据可知, Fe(OH)3完全沉淀的pH值为2.8,pH值约为3时,Al3+、Fe2+不能沉淀,所以调节溶液pH约为3可使Fe3+完全沉淀。
(4)滤渣c由溶液b和MnSO4反应生成,加入适量的双氧水,产生能使带火星小木条复燃的气体,说明滤渣c的主要成分为MnO2,;溶液b中含有KMnO4,具有强氧化性,把Mn2+氧化为MnO2,可写成离子方程式:2 MnO4- +3Mn2+ +2H2O=5MnO2+4 H+。
(5)A12(SO4)3·18H2O溶于水溶液呈酸性,是因为Al3+水解显酸性:Al3++3H2O Al(OH)3+3 H+。
Al(OH)3+3 H+。
考点:本题考查物质制备流程的分析、化学方程式和离子方程式的书写及配平、产物的判断。

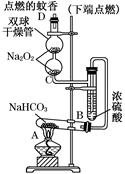
由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因 。
(4)过程ⅱ中产生FeCl2的化学方程式是 。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
(5)下列说法正确的是 。
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是 。