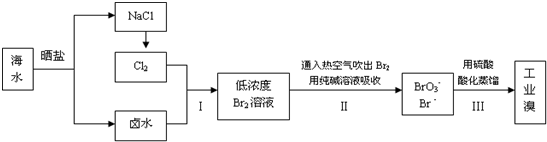
题目内容
9.(1)硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨.用化学方程式表示NO2形成酸雨的原因:3NO2 +H2O=2HNO3 +NO,该反应中氧化剂和还原剂的物质的量之比为1:2.(2)用离子方程式解释实验室盛装强碱性溶液的试剂瓶用橡皮塞而不用玻璃塞的原因:SiO2 +2OH-=SiO32-+H2O.
分析 (1)二氧化氮与水发生反应:3NO2 +H2O=2HNO3 +NO,根据N元素化合价变化,可知其氧化剂的NO2生成NO,起还原剂的NO2生成HNO3;
(2)玻璃中含有二氧化硅,与氢氧化钠溶液反应生成硅酸钠,硅酸钠是无机矿物胶,玻璃塞在瓶口易粘合在一起.
解答 解:(1)二氧化氮与水发生反应:3NO2 +H2O=2HNO3 +NO,有硝酸生成,导致形成酸雨,根据N元素化合价变化,可知其氧化剂的NO2生成NO,起还原剂的NO2生成HNO3,由方程式可知,该反应中氧化剂和还原剂的物质的量之比为1:2,
故答案为:3NO2 +H2O=2HNO3 +NO;1:2;
(2)玻璃中含有二氧化硅,与氢氧化钠溶液反应:SiO2 +2OH-=SiO32-+H2O,生成的硅酸钠是无机矿物胶,玻璃塞在瓶口易粘合在一起,实验室盛装强碱性溶液的试剂瓶用橡皮塞而不用玻璃塞,
故答案为:SiO2 +2OH-=SiO32-+H2O.
点评 本题考查氧化还原反应计算、二氧化氮性质、二氧化性质等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
17.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | CO高温下还原Fe2O3 | D. | 将锌粒投入Cu(NO3)2溶液 |
4.抗生素药物“芬必得”的主要成分的结构简式如图所示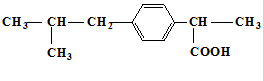 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )
 ,下列关于“芬必得”主要成分的叙述中不正确的是( )
,下列关于“芬必得”主要成分的叙述中不正确的是( )| A. | 该物质的分子式为C13H18O2 | B. | 该物质属于芳香烃 | ||
| C. | 该物质属于羧酸类有机物 | D. | 该物质可以发生取代反应 |
14.下列实验操作正确的是( )
| A. | 用玻璃棒蘸取CH3COOH溶液,点在用水湿润的pH试纸上测定其pH | |
| B. | 用25ml碱式滴定管量取20.00 mL KMnO4溶液 | |
| C. | 为除去苯中的少量苯酚,向混合物中加入适量的氢氧化钠后分液 | |
| D. |  用如图装置加热分解NaHCO3 |
1.下列离子方程式书写错误的是( )
| A. | 小苏打与烧碱溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 硫酸铜与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 向氯化铝溶液中加入足量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 钠与水的反应 2Na+2H2O═2Na++2OH-+H2↑ |
18.在密闭容器中合成氨反应:N2(g)+3H2(g)?2NH3(g),在下列情况下,不能使反应速度加快的是( )
| A. | 加入氮气 | B. | 扩大容器体积,减小压强 | ||
| C. | 加入适量催化剂 | D. | 适当升高温度 |
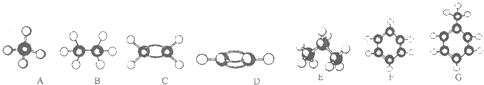
 .
. ,该反应属于取代反应类型.
,该反应属于取代反应类型.