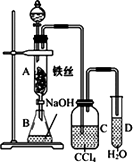
题目内容
某化学课外小组查阅资料发现,实验室制乙烯的反应原理为CH3CH2OH![]() CH2
CH2![]() CH2↑+H2O,制得的乙烯中往往混有CO2、SO2和水蒸气.现拟用下列装置设计一个实验,以验证乙烯中所含杂质气体的成分.
CH2↑+H2O,制得的乙烯中往往混有CO2、SO2和水蒸气.现拟用下列装置设计一个实验,以验证乙烯中所含杂质气体的成分.
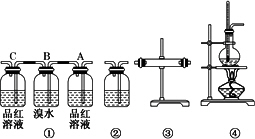
请回答下列问题:
(1)装置的连接顺序(按产物气流从左到右的流向)为________.
(2)装置①中,A瓶中的现象是________,结论为________.B瓶中的现象是________,B瓶中的作用为________.若C瓶中品红溶液不褪色,可得到的结论是________.
(3)装置③中加入的固体药品是________,目的是验证混合气体中含有________,装置②中盛装的溶液是________,目的是验证混合气中含有________.
答案:
解析:
解析:
(每个空格1份)(1)④→③→①→②
(2)品红褪色 混合气中含有SO2 溴水褪色(或颜色变浅) 吸收SO2 混合气中已无SO2
(3)无水CuSO4 水蒸气 澄清石灰水 CO2

练习册系列答案
相关题目
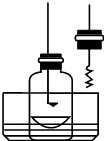 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置.另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用.
步骤2:引燃燃烧匙中的试剂,塞好瓶塞.燃烧结束后,调节广口瓶内外液面相平.
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升.
步骤4:取蒸发皿中得到的固体,加盐酸溶解.向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体.
(1)为除去广口瓶中的氧气,燃烧匙中最好应装入下列试剂中的(填序号)______.A.炭粉 B.铁粉 C.红磷
(2)“步骤2”中调节内外液面相平的方法:______
(3)写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式:______.
(4)某同学直接将镁条在空气中点燃,并将所得白色固体进行“步骤4”的实验,结果无气体生成,其原因是______.
(5)兴趣小组同学为比较镁和铝的金属性强弱,设计了下表中的实验方案一,请你再设计一种不同的实验方案.实验试剂和用品:镁条、铝条、0.1mol?L-1MgCl2溶液、0.1mol?L-1AlCl3溶液、0.1mol?L-1HCl溶液、0.1mol?L-1NaOH 溶液、pH 试纸(其他实验仪器可任选)
| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 | 均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置.另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用.
步骤2:引燃燃烧匙中的试剂,塞好瓶塞.燃烧结束后,调节广口瓶内外液面相平.
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升.
步骤4:取蒸发皿中得到的固体,加盐酸溶解.向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体.
(1)为除去广口瓶中的氧气,燃烧匙中最好应装入下列试剂中的(填序号)______.A.炭粉 B.铁粉 C.红磷
(2)“步骤2”中调节内外液面相平的方法:______
(3)写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式:______.
(4)某同学直接将镁条在空气中点燃,并将所得白色固体进行“步骤4”的实验,结果无气体生成,其原因是______.
(5)兴趣小组同学为比较镁和铝的金属性强弱,设计了下表中的实验方案一,请你再设计一种不同的实验方案.实验试剂和用品:镁条、铝条、0.1mol?L-1MgCl2溶液、0.1mol?L-1AlCl3溶液、0.1mol?L-1HCl溶液、0.1mol?L-1NaOH 溶液、pH 试纸(其他实验仪器可任选)
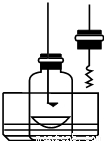
步骤1:用盛水的水槽、无底的废广口瓶、燃烧匙、蒸发皿、胶塞等装配如图所示的装置.另准备一只胶塞,其中有一根铜丝穿过,铜丝末端固定一根镁条备用.
步骤2:引燃燃烧匙中的试剂,塞好瓶塞.燃烧结束后,调节广口瓶内外液面相平.
步骤3:点燃镁条,更换胶塞,镁条继续燃烧,反应结束后,广口瓶内水面上升.
步骤4:取蒸发皿中得到的固体,加盐酸溶解.向溶液中加入过量氢氧化钠溶液,有白色沉淀生成,同时得到一种能使湿润红色石蕊试纸变蓝的气体.
(1)为除去广口瓶中的氧气,燃烧匙中最好应装入下列试剂中的(填序号)______.A.炭粉 B.铁粉 C.红磷
(2)“步骤2”中调节内外液面相平的方法:______
(3)写出Mg3N2溶于足量盐酸生成两种氯化物的化学方程式:______.
(4)某同学直接将镁条在空气中点燃,并将所得白色固体进行“步骤4”的实验,结果无气体生成,其原因是______.
(5)兴趣小组同学为比较镁和铝的金属性强弱,设计了下表中的实验方案一,请你再设计一种不同的实验方案.实验试剂和用品:镁条、铝条、0.1mol?L-1MgCl2溶液、0.1mol?L-1AlCl3溶液、0.1mol?L-1HCl溶液、0.1mol?L-1NaOH 溶液、pH 试纸(其他实验仪器可任选)
| 实验操作 | 实验现象 | |
| 方案一 | 取已除去表面氧化膜的镁条和铝条, 分别和0.1mol?L-1HCl溶液反应 | 均有气泡产生,镁条反应 比铝条反应更剧烈 |
| 方案二 |

 某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.
某化学兴趣小组查阅资料得知镁可在氮气中燃烧生成Mg3N2,并设计如下实验方案进行探究.