题目内容
【题目】下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A. C2H5OH(l)+3O2(g)![]() 2CO2(g)+3H2O(g) ΔH=1 367.0 kJ/mol(燃烧热)
2CO2(g)+3H2O(g) ΔH=1 367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)![]() NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和热)
NaCl(aq)+H2O(l) ΔH=+57.3 kJ/mol(中和热)
C. S(s)+O2(g)![]() SO2(g) ΔH=296.8 kJ/mol(反应热)
SO2(g) ΔH=296.8 kJ/mol(反应热)
D. 2NO2![]() O2+2NO ΔH=+116.2 kJ/mol(反应热)
O2+2NO ΔH=+116.2 kJ/mol(反应热)
【答案】C
【解析】
A、燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,故A错误;B、中和反应是放热反应,△H应小于0,故B错误;C、热化学方程式的书写注明了物质的聚集状态、△H的正负号、数值、单位,硫的燃烧反应为放热反应,△H<0,故C正确;D、热化学反应方程式要注明物质在反应时的状态,故D错误;故选C。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
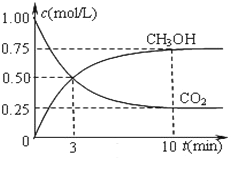
小学期末冲刺100分系列答案【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=__________kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=_________kJ·mol-1
(2)反应①的化学平衡常数K的表达式为_______________;③的化学平衡常数K的表达式为_____________;
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
K为化学平衡常数,其中K和温度的关系如下表:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
根据以上信息推断以下说法正确的是
A. 此反应为放热反应
B. 此反应只有达到平衡时,密闭容器中的压强才不会变化
C. 此反应达到1 000℃时的反应速率比700℃时大
D. 该反应的化学平衡常数越大,反应物的转化率越低