题目内容
【题目】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJmol-1。
2NH3(g) △H=-92kJmol-1。
(1)已知:N2(g)![]() 2N(g) ; H2(g)
2N(g) ; H2(g)![]() 2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
2H(g),则断开1 mol N-H键所需要的能量是_____________kJ。
(2)有利于提高合成氨平衡产率的条件是_______________。
A. 低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。
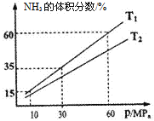
若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp_______(MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留3位小数)。
②T1_____________T2(填“>”、“<”或“=”)。
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g) ![]() 2N*;H2(g)
2N*;H2(g) ![]() 2H*(慢反应)
2H*(慢反应)
第二步 N*+H* ![]() NH*;NH*+H*
NH*;NH*+H* ![]() NH2*;NH2* +H*
NH2*;NH2* +H* ![]() NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* ![]() NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________E2(填“>”、“<”或“=”),判断理由是________________________________________________。
(5)肼(N2H4)又称为联氨,可作火箭发动机的燃料。肼分子的电子式为_________。
【答案】391 AD 0.037 < > 活化能越大,一般分子成为活化分子越难,反应速率越慢 
【解析】
利用化学键的键能数据来计算焓变,可规定吸热为正,放热为负,进行代数和。合成氨是一个正向放热的、气体分子数减小的反应,低温和加压对提高氨气的产率有利;看平衡图像时,可采用“定一议二”的方式进行,固定压强不变,看温度对氨气的含量的影响。
(1)设断开1 mol N-H键所需要的能量是xkJ,则依据N2(g)+3H2(g) ![]() 2NH3(g) △H-92kJmol-1。,有946+436×3-6x=-92,解得x=391;
2NH3(g) △H-92kJmol-1。,有946+436×3-6x=-92,解得x=391;
(2)合成氨反应是一个正向放热的反应,所以降温有利于提高产率;合成氨反应是一个正向气体分子数减小的反应,加压有利于提高产率;
(3) ① N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
初始 1 3 0
变化 x 3x 2x
平衡 1-x 3-3x 2x
60%=![]() ,解得x=0.75mol,所以平衡时N2的物质的量分数为0.1,H2的物质的量分数为0.3,NH3的物质的量分数为0.6,所以Kp=
,解得x=0.75mol,所以平衡时N2的物质的量分数为0.1,H2的物质的量分数为0.3,NH3的物质的量分数为0.6,所以Kp=![]() =0.037;
=0.037;
②从图像来看,当压强不变时,T1时NH3的体积分数大于T2时,根据该反应是放热反应,NH3是生成物的特点,确定T1相对于T2来说是降温,即T1<T2;
(4)由题给信息知,第一步反应慢,第2步反应快,而反应越快,说明其活化能越小,所以第一步反应的活化能大于第2步反应的活化能;
(5)肼(N2H4)又称为联氨,其中氮和氮之间形成单键,肼分子的电子式为 。
。