题目内容
某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知氧化性K2Cr2O7>Cl2,则下列说法正确的是( )
| A、Cl2是该反应的还原产物 |
| B、氧化剂和还原剂的物质的量之比为1:1 |
| C、当转移0.2mol电子时,被氧化的还原剂的物质的量为0.2mol |
| D、由此反应可知还原性HCl<CrCl3 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H20,已知氧化性:K2Cr2O7>Cl2,则K2Cr2O7是氧化剂,Cl2是氧化产物,CrCl3是还原产物,由K元素守恒可知KCl为生成物,根据电子转移守恒可知HCl是反应物,由H元素守恒可知H2O是生成物,发生反应为K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,以此来解答.
解答:
解:由信息可知,发生K2Cr2O7+HCl→KCl+CrCl3+Cl2↑+H2O,
A.Cl元素的化合价升高,则Cl2是该反应的氧化产物,故A错误;
B.Cr元素的化合价由+6价降低为+3价,Cl元素的化合价由-1价升高为0,由电子守恒可知氧化剂与还原剂的物质的量比为(1-0):2×(6-3)=1:6,故B错误;
C.当转移0.2mol电子时,被氧化的还原剂HCl的物质的量为
=0.2mol,故C正确;
D.还原剂的还原性大于还原产物的还原性,则还原性HCl>CrCl3,故D错误;
故选C.
A.Cl元素的化合价升高,则Cl2是该反应的氧化产物,故A错误;
B.Cr元素的化合价由+6价降低为+3价,Cl元素的化合价由-1价升高为0,由电子守恒可知氧化剂与还原剂的物质的量比为(1-0):2×(6-3)=1:6,故B错误;
C.当转移0.2mol电子时,被氧化的还原剂HCl的物质的量为
| 0.2mol |
| (1-0) |
D.还原剂的还原性大于还原产物的还原性,则还原性HCl>CrCl3,故D错误;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
在化学反应Cu+2H2SO4(浓)═CuSO4+SO2↑+H2O中,氧化剂是( )
| A、Cu |
| B、H2SO4 |
| C、CuSO4 |
| D、SO2 |
下列说法正确的是( )
| A、在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH |
| B、用甘氨酸(H2NCCH2COOH)和丙氨酸(CH3CHNH2COOH)缩合,最多可形成4种二肽 |
| C、C2H5Br与NaOH的乙醇溶液混合后加热,将所得气体通入高锰酸钾酸性溶液中,若溶液褪色,则证明有乙烯生成 |
| D、将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
下列化学用语表达正确的是( )
A、Cl-的结构示意图: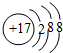 | ||
B、氯化氢分子的电子式: | ||
C、CH4Si的结构式: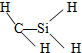 | ||
D、质量数为137的钡原子:
|
在一定温度下,一定体积的密闭容器中,可逆反应A(S)+3B(g)?2C(g)达到平衡时,下列说法正确的是( )
①C的生成速率与C的分解速率相等
②单位时间内a mol A生成,同时消耗3a molB
③气体密度不再变化
④混合气体的总压强不再变化
⑤A、B、C的物质的量比为1:3:2
⑥混合气体的平均相对分子质量不变.
①C的生成速率与C的分解速率相等
②单位时间内a mol A生成,同时消耗3a molB
③气体密度不再变化
④混合气体的总压强不再变化
⑤A、B、C的物质的量比为1:3:2
⑥混合气体的平均相对分子质量不变.
| A、②④⑤ | B、只有① |
| C、①②③④⑥ | D、①②③④⑤ |
在海带中碘的提取和检验实验中,下列操作不正确的是( )
| A、灼烧灰化完成时,用坩埚钳把坩埚移至石棉网上 |
| B、用酒精萃取碘水中的碘 |
| C、用淀粉溶液检验碘的存在 |
| D、上层溶液从分液漏斗上口倒出 |
用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
| A、2g H2含有的氢原子数目为NA |
| B、常温常压下,22.4L O2含有的分子数目为NA |
| C、1L 1mol?L-1 KOH溶液中含有的钾离子数目为NA |
| D、1mol Zn变为Zn2+时失去的电子数目为NA |



