题目内容
12.分离混合液①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 的方法依次是( )| A. | 分液、蒸馏 | B. | 萃取、蒸馏 | C. | 分液、萃取 | D. | 蒸馏、萃取 |
分析 ①乙酸乙酯和乙酸钠溶液分层;
②乙醇和丁醇,互溶,但沸点不同,以此来解答.
解答 解:①乙酸乙酯和乙酸钠溶液分层,选择分液法分离;
②乙醇和丁醇,互溶,但沸点不同,选择蒸馏法分离,
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离方法为解答本题的关键,侧重分析与应用的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
相关题目
2.CO是生产羰基化学品的基本原料,对于以水煤气为原料提取CO的工艺,如果氢气未能充分利用,则提高了CO生产成本,所以在煤化工中常需研究不同温度下的平衡常数、投料比及热值问题.反应CO(g)+H2O (g)?H2(g)+CO2(g)的平衡常数随温度的变化如下表:
(1)上述反应的正反应是放热(填“放热”或“吸热”)反应.
(2)已知在一定温度下:C(s)+CO2(g)?2CO(g) K
C(s)+H2O (g)?H2(g)+CO(g) K1
CO(g)+H2O (g)?H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是K=$\frac{{K}_{1}}{{K}_{2}}$.
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)?H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为0.15mol•L-1•min-1,800℃时a=1.
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(mol•L-1)如下
表,其中达到平衡的是D(填字母).
(4)向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO(g)+H2O (g)?H2(g)+CO2(g).当反应达到平衡时,CO的体积分数为x.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是B
A、0.5molCO+2molH2O(g)+1molCO2+1molH2
B、1molCO+1molH2O(g)+1molCO2+1molH2
C、0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D、0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | a |
(2)已知在一定温度下:C(s)+CO2(g)?2CO(g) K
C(s)+H2O (g)?H2(g)+CO(g) K1
CO(g)+H2O (g)?H2(g)+CO2(g) K2
则K、K1、K2、之间的关系是K=$\frac{{K}_{1}}{{K}_{2}}$.
(3)800℃时,在2L的恒容密闭容器中,充入2.0molCO(g)和3.0molH2O(g),保持温度不变进行反应:CO(g)+H2O (g)?H2(g)+CO2(g),4min时反应达到平衡,测得CO的转化率为60%.
①0~4min内,CO2的平均反应速率为0.15mol•L-1•min-1,800℃时a=1.
②800℃时四个不同容器中发生上述反应,测得各物质的浓度(mol•L-1)如下
表,其中达到平衡的是D(填字母).
| c(CO2) | 3 | 1 | 0.8 | 1 |
| c(H2) | 2 | 1 | 0.8 | 1 |
| c(CO) | 1 | 2 | 3 | 0.5 |
| c(H2O) | 2 | 2 | 3 | 2 |
A、0.5molCO+2molH2O(g)+1molCO2+1molH2
B、1molCO+1molH2O(g)+1molCO2+1molH2
C、0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D、0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2.
3.下列物质中均含杂质(括号中是杂质),除杂质方错误的是( )
| A. | 碳酸钠(碳酸氢钠):加热,直到质量不再减少为止 | |
| B. | 溴苯(溴):加入氢氧化钠溶液洗涤,分液 | |
| C. | 乙醇(乙醛):加入新制氢氧化铜煮沸,过滤 | |
| D. | 乙酸丁酯(乙酸):加入碳酸钠溶液洗涤,分液 |
20.过氧化钠是一种制氧剂,它和二氧化碳反应方程式为:2Na2O2+2CO2→2Na2CO3+O2下列说法正确的是( )
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | Na2CO3是还原产物,O2是氧化产物 | |
| C. | 每转移4摩尔电子,有1摩尔氧气生成 | |
| D. | 1摩尔CO2参加反应就会产生11.2LO2 |
7.原子的种类取决于( )
| A. | 质子数 | B. | 质量数 | C. | 质子数和中子数 | D. | 原子序数 |
17.反应A2(g)+B2(g)→2AB(g)的能量变化如图所示,叙述正确的是( )
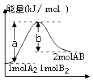

| A. | 该反应是放热反应 | |
| B. | 加入催化剂,(b-a)的差值减小 | |
| C. | 每生成2molAB分子吸收bkJ热量 | |
| D. | 若反应生成AB为液态,吸收的热量小于(a-b)kJ |
4.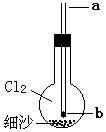 如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )
如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )
 如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )
如图烧瓶内充满氯气,底部有层细沙(不参与反应),b处塞有小块钠.从a口用细铁丝把钠送下去,再从a口滴下一滴水,恰好滴在钠块上,立即剧烈反应,烧瓶内产生大量白色烟雾.不正确的说法是( )| A. | 水可能参与二个氧化还原反应 | |
| B. | Cl2可能参与四个氧化还原反应 | |
| C. | 氧元素参与的反应一定是氧化还原反应 | |
| D. | 氢元素参与的反应包含被氧化与被还原过程 |
1.用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( )

| A. | 甲是原电池,乙是电解池 | |
| B. | 甲中铁棒比乙中铁棒更易腐蚀 | |
| C. | d电极上的电极反应是:Fe-2e→Fe2+ | |
| D. | b电极上的电极反应是:O2+2H2O+4e→4OH- |
2.用下列装置完成相关实验,合理的是( ) )
| A. | 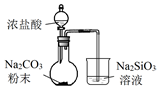 验证H2CO3酸性强于H2SiO3 | B. |  收集CO2或NH3 | ||
| C. | 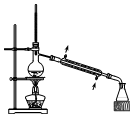 分离Na2CO3溶液与CH3COOC2H5 | D. | 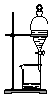 分离CH3CH2OH与CH3COOC2H5 |