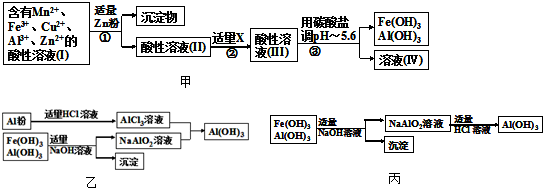
题目内容
某H2SO4,FeSO4,Fe2(SO4)3混合溶液100mL,已知溶液中各阳离子的物质的量浓度相等,硫酸根离子总浓度为6mol·L-1,此溶液中可溶解铁粉的质量为(已知2Fe3++Fe=3Fe2+)
[ ]
A.10.6g
B.11.2g
C.33.6g
D.5.6g
答案:B
解析:
提示:
解析:
|
本题要求溶解的Fe粉质量,由方程式Fe+2H+=Fe2++H2↑,2Fe3++Fe=3Fe2+可知,需要求得H+,Fe3+的物质的量的浓度;因溶液中电荷守恒,故有n(H+)+2n(Fe2+)+3n(Fe3+)=2n( |
提示:
|
解题的关键是求溶液中阳离子的物质的量,若不用电荷守恒则费时易错,抓住电荷守恒则可准确快速求解.希望同学们掌握电荷守恒的实质并能运用于解题. |

练习册系列答案
相关题目
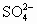 );又因溶液中阳离子浓度相等,设均为a mol·L-1,则有a+2×a+3×a=2×6mol·L-1,解得a=2mol·L-1,故溶液中含H+及Fe3+的物质的量均为0.2mol,由反应方程式可知消耗Fe粉的物质的量为
);又因溶液中阳离子浓度相等,设均为a mol·L-1,则有a+2×a+3×a=2×6mol·L-1,解得a=2mol·L-1,故溶液中含H+及Fe3+的物质的量均为0.2mol,由反应方程式可知消耗Fe粉的物质的量为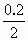 +
+