题目内容
(1)NaCl溶液混有Na2CO3,除杂试剂可以是 (填化学式),其离子方程式为 .
(2)如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.则甲瓶中所盛的试剂可能是 .
(2)如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.则甲瓶中所盛的试剂可能是

考点:实验装置综合,离子方程式的书写,物质的分离、提纯和除杂
专题:
分析:(1)Na2CO3可与盐酸反应生成NaCl,进而除去杂质;
(2)若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,可能有两种情况:一是氯气在甲中被干燥,二是氯气被吸收.
(2)若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,可能有两种情况:一是氯气在甲中被干燥,二是氯气被吸收.
解答:
解:(1)阴离子不同,加盐酸生成气体的为碳酸钠,则选择试剂为盐酸,发生的离子反应为2H++CO32-=CO2↑+H2O,故答案为:盐酸;2H++CO32-=CO2↑+H2O;
(2)若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色,则可能有两种情况:一是氯气在甲中被干燥,二是氯气被吸收,可能为浓硫酸或氢氧化钠溶液,
故答案为:浓硫酸或氢氧化钠溶液.
(2)若关闭Ⅰ阀,打开Ⅱ阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色,若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色,则可能有两种情况:一是氯气在甲中被干燥,二是氯气被吸收,可能为浓硫酸或氢氧化钠溶液,
故答案为:浓硫酸或氢氧化钠溶液.
点评:本题考查混合物的分离、提纯,侧重物质的鉴别、除杂及离子反应的考查,把握物质的性质选择合适的试剂进行除杂为解答的关键,题目难度不大.

练习册系列答案
相关题目
下列实验操作中,溶液里不可能有固体析出的是( )
| A、MgCl2溶液中加入一粒绿豆大小的Na |
| B、饱和Ca(OH)2溶液中加入一粒绿豆大小的Na |
| C、CuSO4溶液中加入一粒绿豆大小的Na |
| D、水中加入一粒绿豆大小的Na |
常温下,下列各组离子在制定溶液中一定能大量共存的是( )
| A、澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
| B、c(Fe3+)=0.1mol?L-1的溶液中:Na+、NH4+、SCN-、SO42- |
| C、加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- |
| D、0.1mol?L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |
向饱和BaSO4 溶液中加水,下列叙述正确的是( )
| A、BaSO4 溶解度增大、Ksp不变 |
| B、BaSO4 溶解度、Ksp均增大 |
| C、BaSO4 溶解度不变、Ksp增大 |
| D、BaSO4 溶解度、Ksp均不变 |
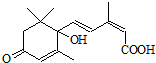 用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )
用S-诱抗素制剂,可以保证鲜花盛开.S-诱抗素的结构如图,则下列关于该物质的说法正确的是( )| A、其分子中含有一个手性碳原子 |
| B、只能发生加聚反应,不能发生缩聚反应 |
| C、1 mol该物质与NaOH溶液反应,最多消耗2 mol NaOH |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
下列说法正确的是( )
| A、在新制的氯水中加入NaOH溶液至中性时,满足c(Na+)=c(ClO-)+c(HClO) |
| B、25℃时,稀释0.5 mol?L-1的NH4Cl溶液,水解平衡右移,水解平衡常数Kh增大,而Kw不变 |
| C、常温下,pH=11的某碱MOH溶液与pH=3的盐酸等体积混合后,溶液可能呈中性或酸性 |
| D、0.2mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合,则:2c(H+)-2c(OH)=C(CH3COO)-C(CH3COOH) |
一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图示的是( )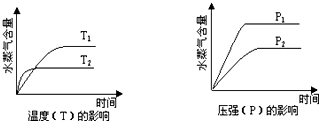

| A、CO2(g)+2NH3(g) CO(NH2)2(s)+H2O(g);△H<0 |
| B、2C6H5CH2CH3(g)+O2(g) 2C6H5CH=CH2(g)+2H2O(g);△H<0 |
| C、CH3CH2OH(g) CH2=CH2(g)+H2O(g);△H>0 |
| D、CO2(g)+H2(g) CO(g)+H2O(g);△H>0 |