题目内容
18.如图是实验室制备1,2二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)反应原理:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,CH2=CH2+Br2CH2BrCH2Br装置A中发生副反应之一是:CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+9H2O.
1,2-二溴乙烷主要的物理性质如下:
| 熔点 | 沸点 | 密度 | 溶解性 |
| 9.79℃ | 131.4℃ | 2.18g•cm-3 | 难溶于水,易溶于醇,醚生等有机溶剂 |
(1)装置A是由乙醇制备乙烯的反应装置图,其中使用连通滴液漏斗的原因是使连通滴液漏斗里的溶液容易流下.
(2)装置B是安全瓶,用于监测实验进行时E中是否发生堵塞,请写出堵塞时的现象玻璃管中液面上升
装置E中盛放泠水的主要目的是避免溴大量挥发(乙烯与溴反应时放热),但又不能过冷却(如用冰水),其原因是1,2-二溴乙烷的熔点为9.79℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管.
(3)装置C的作用是吸收乙烯中混有的SO2、CO2,装置F中发生反应的离子方程式为Br2+20H+=Br-+BrO-+H2O
(4)将1,2-二溴乙烷粗产品置于分钟液漏斗中加水,振荡后静置,产物在下层(填“上”或“下”)
(5)有学生提出,装置D中可改用酸性高锰酸钾溶液来验证气体,请判断这种做法是否可行否(填“是”或“否”),其原因是乙烯和SO2均能与酸高锰酸钾溶液反应.
分析 (1)使用连通滴液漏斗可以保证气压畅通,让液体顺利流下;
(2)B是安全瓶,用于监测实验进行时E中是否发生堵塞,根据气压原理确定堵塞时的现象;根据表中数据:1,2-二溴乙烷的熔点为9.79℃,若温度过低,1,2-二溴乙烷会凝固为固体;
(3)实验室制取的乙烯中含有杂质,需要除杂,根据溴单质可以和氢氧化钠之间反应生成溴化钠、次溴酸钠和水来书写方程式;
(4)根据1,2-二溴乙烷的密度比水大,难溶于水的性质来回答;
(5)高锰酸钾可以和乙烯之间发生氧化还原反应.
解答 解:(1)使用连通滴液漏斗起到了均衡气压的作用,这样可以保证气压畅通,让液体顺利流下,故答案为:使连通滴液漏斗里的溶液容易流下;
(2))安全瓶用于监测实验进行时E中是否发生堵塞,若发生堵塞,装置中压强升高,则会看到玻璃管中液面上升;由表中可知1,2-二溴乙烷的熔点为9.79℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管,故答案为:玻璃管中液面上升;1,2-二溴乙烷的熔点为9.79℃,若温度过低,1,2-二溴乙烷会凝固而堵塞导管;
(3)实验室制取的乙烯中含有杂质SO2、CO2,可以用氢氧化钠溶液来除杂,溴单质可以和氢氧化钠之间反应生成溴化钠、次溴酸钠和水,离子方程式为 Br2+20H+=Br-+BrO-+H2O;
故答案为:吸收乙烯中混有的SO2、CO2; Br2+20H+=Br-+BrO-+H2O;
(4)1,2-二溴乙烷的密度比水大,难溶于水,所以1,2-二溴乙烷在下层,故答案为:下;
(5)装置D中改用酸性高锰酸钾溶液来验证气体不合理,因为高锰酸钾可以和乙烯之间发生氧化还原反应,不能达到制取乙烯的目的,故答案为:否;乙烯和SO2均能与酸高锰酸钾溶液反应.
点评 本题考查有机物的制取实验设计,解答本题的关键是把握制备实验的原理,牢固把握实验基本操作以及除杂问题是解答该类题目的保证,题目难度中.

| A. | 1mol Ne含有的电子数目为10NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸含有相同的氧原子数 | |
| C. | 2.8g氮气所含的分子数为NA | |
| D. | 1.8gNH4+中含有的质子数为NA |
| A. | 氧元素的相对原子质量为$\frac{12a}{b}$ | B. | 1 mol该原子质量为aNAg | ||
| C. | x g该氧原子所含的电子数为$\frac{8x}{a}$ | D. | y g该氧原子的中子数一定为$\frac{8y}{a}$ |

| A. | Ir元素是第六周期第Ⅷ族的金属元素 | |
| B. | IrO4+中Ir的氧化数(即化合价)为+9价 | |
| C. | 在[Ir(CO)3]3-中存在极性键 | |
| D. | IrO4失去1个e-生成IrO4+,发生还原反应 |

 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.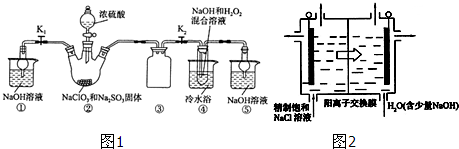


 ).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2:
).实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应如图1:操作流程如图2: .
. +3NaOH
+3NaOH CH3COONa+2H2O+
CH3COONa+2H2O+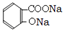 .
.