题目内容
把200mL有BaCl2和KCl的混合溶液分成2等份,取一份加入含 A mol硫酸钾的溶液,恰好使钡离子完全沉淀;另取一份加入含 B mol硝酸银的溶液,恰好使氯离子完全沉淀.则:每份溶液中:n(Ba2+)= mol,n(Cl-)= mol;
200mL原混合溶液中:c(Cl-)= mol?L-1,c(K+)= mol?L-1.
200mL原混合溶液中:c(Cl-)=
考点:化学方程式的有关计算
专题:计算题
分析:由Ba2++SO42-═BaSO4↓、Ag++Cl-═AgCl↓计算离子的物质的量,由混合溶液分成2等份,则确定原溶液中钡离子和氯离子的浓度,再利用溶液不显电性来计算原混合溶液中钾离子物质的量浓度.
解答:
解:由于Ba2++SO42-═BaSO4↓,所以n(Ba2+)=n(SO42-)=A mol;Ag++Cl-═AgCl↓,n(Cl-)=n(NO3-)=B mol;每份溶液中:n(Ba2+)=A mol,n(Cl-)=Bmol;由混合溶液分成2等份,则原溶液中钡离子的浓度为
=10Aol/L,
氯离子的浓度为:
=10Bmol/L,
根据溶液不显电性,设原混合溶液中钾离子物质的量浓度为x,
则10Amol/L×2+x×1=10Bmol/L×1,
解得x=10(B-2A)mol/L,
故答案为:A,B,10B,10(B-2A).
| Amol×2 |
| 0.2L |
氯离子的浓度为:
| Bmol×2 |
| 0.2L |
根据溶液不显电性,设原混合溶液中钾离子物质的量浓度为x,
则10Amol/L×2+x×1=10Bmol/L×1,
解得x=10(B-2A)mol/L,
故答案为:A,B,10B,10(B-2A).
点评:本题考查物质的量计算,难度不大,应利用离子方程式计算,同时应考虑所计算的物理量,不要答非所问.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
下列单质不能保存在煤油或石蜡油中的是( )
| A、K | B、Na | C、Ca | D、Li |
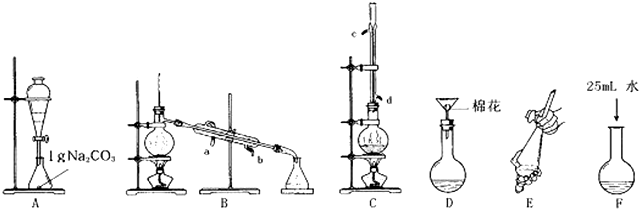
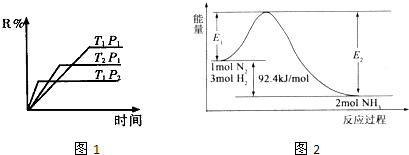
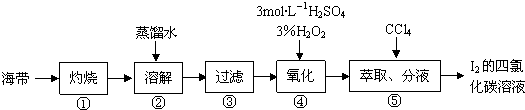
如图所示实验设计能达到相应实验目的是( )


| A、用图①装置验证氯、碳、硅元素非金属性 |
| B、用图②装置能收集O2、CO2和H2 |
| C、用图③装置电解精炼铝 |
| D、用图④装置验证NaHCO3和Na2CO3的热稳定性 |

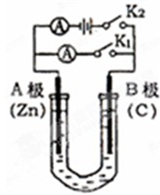 如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.
如图所示,U形管内盛有100mL的溶液,请按要求回答下列回答.


