题目内容
在电子工业中利用镁制取硅的反应为2Mg+SiO2
2MgO+Si,同时会发生副反应:2Mg+Si
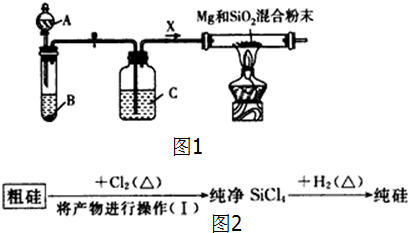
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易自燃的气体.如图1是进行Mg与SiO2反应的实验装置.试回答下列问题.
(1)由于O2和H2O(g)的存在对该实验有不良影响,实验中应通入X气体作为保护气.在A、B、C三种仪器中反应开始前的 试剂分别是:A ,B ,C (填序号).
①稀硫酸 ②浓硫酸 ③稀盐酸 ④石灰石 ⑤纯碱 ⑥锌粒
(2)实验开始时,必须先通入X气体,再加热反应物,其理由是 ;当反应引发后,移走酒精灯,反应能继续进行,其原因是 .
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因用化学方程式表示为:① ,② .
(4)这样制得的硅会混有杂质(如SiO2等)而称粗硅,有人设计了如图2下流程进行提纯:
其中涉及的化学方程式为 .
| ||
| ||
(1)由于O2和H2O(g)的存在对该实验有不良影响,实验中应通入X气体作为保护气.在A、B、C三种仪器中反应开始前的 试剂分别是:A
①稀硫酸 ②浓硫酸 ③稀盐酸 ④石灰石 ⑤纯碱 ⑥锌粒
(2)实验开始时,必须先通入X气体,再加热反应物,其理由是
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因用化学方程式表示为:①
(4)这样制得的硅会混有杂质(如SiO2等)而称粗硅,有人设计了如图2下流程进行提纯:
其中涉及的化学方程式为

考点:性质实验方案的设计
专题:实验设计题
分析:(1)Mg可以与CO2、N2发生化学反应,Mg与氢气不能发生反应;制备氢气用稀硫酸和锌粒,通过浓硫酸干燥;
(2)不纯的氢气燃烧会发生爆炸;Mg与SiO2反应的条件是加热,反应的条件由反应放热维持;
(3)Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易自燃的气体;
(4)硅会混有杂质(如SiO2等)而称粗硅,Si与氯气反应生成生成四氯化硅,再用氢气还原四氯化硅得到纯净的Si.
(2)不纯的氢气燃烧会发生爆炸;Mg与SiO2反应的条件是加热,反应的条件由反应放热维持;
(3)Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易自燃的气体;
(4)硅会混有杂质(如SiO2等)而称粗硅,Si与氯气反应生成生成四氯化硅,再用氢气还原四氯化硅得到纯净的Si.
解答:
解:(1)Mg可以与CO2、N2发生化学反应,Mg与氢气不能发生反应,因此可用氢气作为保护气;选用的药品为稀硫酸和锌粒,再用浓硫酸干燥,所以C为浓硫酸;
故答案为:①、⑥、②;
(2)装置中有空气,若不用氢气排空装置中的空气,氢气和空气的混合气体燃烧会发生爆炸,所以反应开始前应该先通氢气排尽装置中的空气;Mg与SiO2反应的条件是加热,停止加热后,反应的条件由反应放出的热量维持,
故答案为:防止加热条件下H2与空气混合爆炸;Mg与SiO2的反应是放热反应;
(3)Mg2Si遇盐酸迅速反应生成SiH4(硅烷),其反应的方程式为:Mg2Si+4H2O=2Mg(OH)2↓+SiH4,SiH4常温下是一种不稳定、易自燃的气体,反应的方程式为SiH4+2O2═SiO2+2H2O,所以往反应后的混合物中加入稀盐酸,可观察到闪亮的火星;
故答案为:Mg2Si+4H2O=2Mg(OH)2↓+SiH4;SiH4+2O2═SiO2+2H2O;
(4)硅会混有杂质(如SiO2等)而称粗硅,Si与氯气反应生成生成四氯化硅,则反应的方程式为:Si+2Cl2
SiCl4,再用氢气还原四氯化硅得到纯净的Si,其反应的方程式为:SiCl4+2H2
Si+4HCl;
故答案为:Si+2Cl2
SiCl4、SiCl4+2H2
Si+4HCl.
故答案为:①、⑥、②;
(2)装置中有空气,若不用氢气排空装置中的空气,氢气和空气的混合气体燃烧会发生爆炸,所以反应开始前应该先通氢气排尽装置中的空气;Mg与SiO2反应的条件是加热,停止加热后,反应的条件由反应放出的热量维持,
故答案为:防止加热条件下H2与空气混合爆炸;Mg与SiO2的反应是放热反应;
(3)Mg2Si遇盐酸迅速反应生成SiH4(硅烷),其反应的方程式为:Mg2Si+4H2O=2Mg(OH)2↓+SiH4,SiH4常温下是一种不稳定、易自燃的气体,反应的方程式为SiH4+2O2═SiO2+2H2O,所以往反应后的混合物中加入稀盐酸,可观察到闪亮的火星;
故答案为:Mg2Si+4H2O=2Mg(OH)2↓+SiH4;SiH4+2O2═SiO2+2H2O;
(4)硅会混有杂质(如SiO2等)而称粗硅,Si与氯气反应生成生成四氯化硅,则反应的方程式为:Si+2Cl2
| ||
| ||
故答案为:Si+2Cl2
| ||
| ||
点评:本题考查了物质的制备原理和装置选择、实验步骤的设计分析判断,把握物质的性质是解题关键,题目难度中等,侧重于考查学生的实验探究能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于同位素的概念,下列叙述中正确的是( )
| A、原子序数相等,化学性质与质量数不同 |
| B、原子序数相等,并有相同的化学性质和相同的质量数 |
| C、原子序数相等,化学性质几乎完全相同,而中子数不同 |
| D、化学性质相同,而质量数与原子序数不同 |
将35.2g硫化亚铁和氢氧化铁的混合物放入一定体积的0.5 mol?L-1 H2SO4 溶液中恰好完全反应,并得到3.2g黄色沉淀,则下列有关判断正确的是( )
| A、原混合物中氢氧化铁的质量分数可能为70% |
| B、所需0.5 mol?L-1 H2SO4 溶液的体积为600mL |
| C、原混合物中硫化亚铁的质量分数可能为25% |
| D、反应中转移电子物质的量为0.4mol |
下列化学反应对应的离子方程式正确的是( )
| A、Na2S溶液使酚酞试液变红:S2-+2H2O═2OH-+H2S |
| B、在醋酸溶液中加入Na2CO3溶液:CO32-+2H+=CO2↑+H2O |
| C、碳酸氢铵溶液和足量氢氧化钠溶液混合:NH4++OH+=NH3?H2O |
| D、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |