题目内容
18.镁、铝、铁及其化合物在生产和生活中有广泛的应用.(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg):n(Al)=1:2.
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料.取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2$\stackrel{煅烧}{→}$2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应).该硫铁矿中FeS2的质量分数为78%.
铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)].将一块带锈铁片放入700mL 1.0mol/L的稀硝酸中充分反应,收集到标准状况下NO气体3.584L,最终剩余2.020g铁.该过程中可能发生的反应有:
①Fe+4HNO3→Fe(NO3)3+NO↑+2H2O ②3Fe+8HNO3→3Fe(NO3)2+2NO↑+4H2O
③FeO(OH)+3HNO3→Fe(NO3)3+2H2O ④Fe+2Fe(NO3)3→3Fe(NO3)2.
(3)试确定反应后溶液中溶质的成分与物质的量.
(4)原带锈铁片中铁锈的质量分数.
分析 (1)令镁、铝的物质的量分别为xmol、ymol,根据电子转移守恒、二者质量之和列方程计算x、y的值,据此解答;
(2)发生反应4FeS2+11O2=2Fe2O3+8SO2,导致固体质量减少,根据固体的质量差,利用差量法计算FeS2的质量,再根据质量分数定义计算;
(3)完全反应后铁有剩余,说明硝酸完全反应,则溶液中溶质为硝酸亚铁,n(NO)=$\frac{3.584L}{22.4L/mol}$=0.16mol,根据N原子守恒计算硝酸亚铁的物质的量;
(4)根据铁原子守恒、转移电子守恒计算铁锈的物质的量,再根据质量分数公式计算铁锈质量分数.
解答 解:(1)令镁、铝的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{24x+27y=3.9}\\{2x+3y=0.2×2}\end{array}\right.$
解得x=0.05,y=0.1,
故n(Mg):n(Al)=0.05mol:0.1mol=1:2,
故答案为:1:2;
(2)发生反应4FeS2+11O2=2Fe2O3+8SO2,导致固体质量减少,固体质量减少10g-7.4g=2.6g,则:
4FeS2+11O2=2Fe2O3+8SO2 质量减少△m
480 160
m(FeS2) 2.6g
故m(FeS2)=2.6g×$\frac{480}{160}$=7.8g,
故FeS2的质量分数为$\frac{7.8g}{10g}$×100%=78%,
故答案为:78%;
(3)完全反应后铁有剩余,说明硝酸完全反应,溶液中溶质为硝酸亚铁,n(NO)=$\frac{3.584L}{22.4L/mol}$=0.16mol,n(HNO3)=1mol/L×0.7L=0.7mol,根据N原子守恒得n[Fe(NO3)2]=$\frac{0.7mol-0.16mol}{2}$=0.27mol,
答:反应后溶液中溶质的成分为Fe(NO3)2,物质的量的为0.27mol;
(4)设铁锈的物质的量为xmol,根据铁原子守恒得,参加氧化还原反应的n(Fe)=0.27mol-xmol,根据转移电子守恒得xmol+0.16mol×3=(0.27-x)mol×2,x=0.02,原来铁的质量=2.020g+(0.27-0.02)mol×56g/mol=16.020g,铁锈的质量分数=$\frac{0.02mol×89g/mol}{0.02mol×89g/mol+16.020g}$×100%=10%,
答:原带锈铁片中铁锈的质量分数为10%.
点评 本题考查了根据方程式计算,根据物质的性质确定溶质成分,再结合原子守恒、转移电子守恒计算铁锈质量分数,题目难度中等.

 名校课堂系列答案
名校课堂系列答案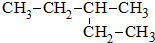 其系统命名正确的是( )
其系统命名正确的是( )| A. | 2-乙基丁烷 | B. | 3-乙基丁烷 | C. | 3-甲基丁烷 | D. | 3-甲基戊烷 |

| A. | ①②③ | B. | ③①② | C. | ③②① | D. | ②①③ |
| A. | 铁、铝的都属于轻金属 | |
| B. | 生铁的硬度和熔点都比纯铁高 | |
| C. | 铁、铝的单质都具有银白色金属光泽,都属于有色金属 | |
| D. | 金属形成合金后通常具有更多优良性能,所以用途更广泛 |
| A. | Ca2+和Cl- | B. | F-与Na+ | C. | K+和Mg2+ | D. | Al3+和S2- |
| A. | 16O2和18O | B. | 146C 和147N | C. | 2H和3H | D. | 1H2和2H2 |
