题目内容
将8.8g FeS固体置于200mL 2.0mol?L-1的盐酸中,以制备H2S气体.反应完全后,若溶液中H2S的浓度为0.10mol?L-1,假定溶液体积不变,试计算:
(1)收集到的H2S气体的体积(标准状况).
(2)溶液中Fe2+和H+的物质的量浓度(摩尔浓度).
解:(1)FeS的物质的量为 =0.1mol,盐酸的物质的量为0.2L×2.0mol?L-1=0.4mol,根据方程式FeS+2H+═Fe2++H2S↑可判断盐酸过量,计算应以FeS的物质的量为基准,则共生成H2S 0.1mol.在溶液中溶解的物质的量为:0.10mol?L-1×0.2L=0.02mol,所以收集到的H2S气体的物质的量为0.08mol,其体积为:0.08mol×22.4L/mol=1.8L,
=0.1mol,盐酸的物质的量为0.2L×2.0mol?L-1=0.4mol,根据方程式FeS+2H+═Fe2++H2S↑可判断盐酸过量,计算应以FeS的物质的量为基准,则共生成H2S 0.1mol.在溶液中溶解的物质的量为:0.10mol?L-1×0.2L=0.02mol,所以收集到的H2S气体的物质的量为0.08mol,其体积为:0.08mol×22.4L/mol=1.8L,
答:收集到的H2S气体的体积(标准状况)为1.8L.
(2)参加反应的FeS的物质的量0.1mol,根据方程式FeS+2H+═Fe2++H2S↑得Fe2+的物质的量为0.1mol,消耗掉H+0.20 mol,反应前H+的物质的量为:2.0 mol?L-1×0.20 L=0.40 mol,剩余的H+的物质的量为0.40 mol-0.20 mol=0.20 mol,所以Fe2+的物质的量浓度为 =0.5mol?L-1,H+的物质的量浓度为
=0.5mol?L-1,H+的物质的量浓度为 =1.0mol?L-1,
=1.0mol?L-1,
答:溶液中Fe2+的物质的量浓度为0.5mol?L-1;H+的物质的量浓度为1.0mol?L-1.
分析:(1)先进行过量判断,然后根据方程式进行计算;
(2)先求出各自的物质的量然后代入公式C=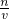 来解;
来解;
点评:本题考查物质的量浓度的计算题目,难度不大,注意有关计算公式的运用.
 =0.1mol,盐酸的物质的量为0.2L×2.0mol?L-1=0.4mol,根据方程式FeS+2H+═Fe2++H2S↑可判断盐酸过量,计算应以FeS的物质的量为基准,则共生成H2S 0.1mol.在溶液中溶解的物质的量为:0.10mol?L-1×0.2L=0.02mol,所以收集到的H2S气体的物质的量为0.08mol,其体积为:0.08mol×22.4L/mol=1.8L,
=0.1mol,盐酸的物质的量为0.2L×2.0mol?L-1=0.4mol,根据方程式FeS+2H+═Fe2++H2S↑可判断盐酸过量,计算应以FeS的物质的量为基准,则共生成H2S 0.1mol.在溶液中溶解的物质的量为:0.10mol?L-1×0.2L=0.02mol,所以收集到的H2S气体的物质的量为0.08mol,其体积为:0.08mol×22.4L/mol=1.8L,答:收集到的H2S气体的体积(标准状况)为1.8L.
(2)参加反应的FeS的物质的量0.1mol,根据方程式FeS+2H+═Fe2++H2S↑得Fe2+的物质的量为0.1mol,消耗掉H+0.20 mol,反应前H+的物质的量为:2.0 mol?L-1×0.20 L=0.40 mol,剩余的H+的物质的量为0.40 mol-0.20 mol=0.20 mol,所以Fe2+的物质的量浓度为
 =0.5mol?L-1,H+的物质的量浓度为
=0.5mol?L-1,H+的物质的量浓度为 =1.0mol?L-1,
=1.0mol?L-1,答:溶液中Fe2+的物质的量浓度为0.5mol?L-1;H+的物质的量浓度为1.0mol?L-1.
分析:(1)先进行过量判断,然后根据方程式进行计算;
(2)先求出各自的物质的量然后代入公式C=
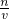 来解;
来解;点评:本题考查物质的量浓度的计算题目,难度不大,注意有关计算公式的运用.

练习册系列答案
相关题目
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HA物质的量浓度 (mol?L-1) | NaOH物质的量浓度 (mol?L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2______(选填“是”或“否”).混合液中离子浓度c(A-)与 c(Na+)的大小关系是______.
(3)丙组实验结果分析,HA是______酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是______.
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=______mol?L-1.写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)-c(A-)=______mol?L-1 c(OH-)-c(HA)=______mol?L-1.

