题目内容
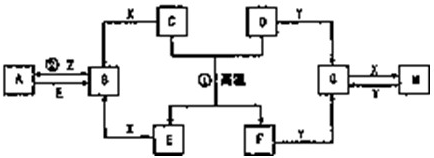
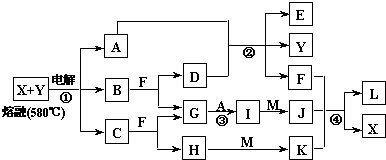
如图表示各物质之间的转化关系,A、B、C、G为单质,其中A、G为气体,F为液体.②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,常用作干燥剂,M是一种两性化合物,L是一种白色胶状沉淀.
试回答下列有关问题:
(1)M的化学式______.
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的:______;工业生产中,还常常利用电解X和F的混合物制取______.(填化学式)
(3)反应②的化学方程式是______.
(4)反应④的离子反应方程式是______.
(5)用化学方程式表示E在空气中失效的反应原理______.
解:如图表示各物质之间的转化关系,A、B、C、G为单质,其中A、G为气体,F为液体.②为工业生产中常见反应,E是一种具有漂白作用的盐,推断为Ca(ClO)2;Y易潮解,常用作干燥剂,推断为CaCl2;结合转化关系可知,F为H2O,A为Cl2,D为Ca(OH)2;B+F(H2O)=D(Ca(OH)2)+G,推断B为Ca,G为H2,I为HCl,M是一种两性化合物,L是一种白色胶状沉淀;判断L为Al(OH)3,M为Al2O3,J为AlCl3,依据离子性质推断K为偏铝酸盐;H为碱,C为Na,H为NaOH,电解熔融物得到金属Ca、Na、Cl2;说明xy为NaCl、CaCl2;
(1)依据推断可知M为:Al2O3;故答案为:Al2O3;
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,工业上这样做的目的是:降低X、Y熔化时的温度,节约能源; 常常利用电解X和F的混合物为饱和食盐水,制取 Cl2、H2和NaOH;故答案为:降低X、Y熔化时的温度,节约能源;Cl2、H2和NaOH;
(3)分析判断反应②是工业制漂白粉的反应,反应的化学方程式是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)反应④是铝盐和偏铝酸盐在水溶液中的双水解反应生成氢氧化铝沉淀,反应的离子反应方程式是:Al3++3AlO2-+6H2O=4Al(OH)3↓;
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(5)E在空气中失效的反应原理是次氯酸钙和空气中的二氧化碳水反应生成次氯酸,次氯酸见光分解生成氧气和盐酸,使漂白粉失去作用,反应过程中的化学方程式为:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2HClO 2HCl+O2↑;
2HCl+O2↑;
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2HClO 2HCl+O2↑;
2HCl+O2↑;
分析:如图表示各物质之间的转化关系,A、B、C、G为单质,其中A、G为气体,F为液体.②为工业生产中常见反应,E是一种具有漂白作用的盐,推断为Ca(ClO)2;Y易潮解,常用作干燥剂,推断为CaCl2;结合转化关系可知,F为H2O,A为Cl2,D为Ca(OH)2;B+F(H2O)=D(Ca(OH)2)+G,推断B为Ca,G为H2,I为HCl,M是一种两性化合物,L是一种白色胶状沉淀;判断L为Al(OH)3,M为Al2O3,J为AlCl3,依据离子性质推断K为偏铝酸盐;H为碱,C为Na,H为NaOH,电解熔融物得到金属Ca、Na、Cl2;说明xy为NaCl、CaCl2;依据判断出的物质分析回答问题
点评:本题考查了物质转化关系的分析应用,物质性质的应用和判断,主要是电解原理反应的应用,工业制漂白粉的反应,氯碱工业的反应,金属与水的反应,其中,两性物质和漂白粉的制备是解题关键,题目难度较大.
(1)依据推断可知M为:Al2O3;故答案为:Al2O3;
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,工业上这样做的目的是:降低X、Y熔化时的温度,节约能源; 常常利用电解X和F的混合物为饱和食盐水,制取 Cl2、H2和NaOH;故答案为:降低X、Y熔化时的温度,节约能源;Cl2、H2和NaOH;
(3)分析判断反应②是工业制漂白粉的反应,反应的化学方程式是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)反应④是铝盐和偏铝酸盐在水溶液中的双水解反应生成氢氧化铝沉淀,反应的离子反应方程式是:Al3++3AlO2-+6H2O=4Al(OH)3↓;
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(5)E在空气中失效的反应原理是次氯酸钙和空气中的二氧化碳水反应生成次氯酸,次氯酸见光分解生成氧气和盐酸,使漂白粉失去作用,反应过程中的化学方程式为:
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2HClO
 2HCl+O2↑;
2HCl+O2↑;故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 2HClO
 2HCl+O2↑;
2HCl+O2↑;分析:如图表示各物质之间的转化关系,A、B、C、G为单质,其中A、G为气体,F为液体.②为工业生产中常见反应,E是一种具有漂白作用的盐,推断为Ca(ClO)2;Y易潮解,常用作干燥剂,推断为CaCl2;结合转化关系可知,F为H2O,A为Cl2,D为Ca(OH)2;B+F(H2O)=D(Ca(OH)2)+G,推断B为Ca,G为H2,I为HCl,M是一种两性化合物,L是一种白色胶状沉淀;判断L为Al(OH)3,M为Al2O3,J为AlCl3,依据离子性质推断K为偏铝酸盐;H为碱,C为Na,H为NaOH,电解熔融物得到金属Ca、Na、Cl2;说明xy为NaCl、CaCl2;依据判断出的物质分析回答问题
点评:本题考查了物质转化关系的分析应用,物质性质的应用和判断,主要是电解原理反应的应用,工业制漂白粉的反应,氯碱工业的反应,金属与水的反应,其中,两性物质和漂白粉的制备是解题关键,题目难度较大.

练习册系列答案
相关题目


 ]2-Na+
]2-Na+