题目内容
(1)下列关于工业生产说法正确的是 .(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
如图所示是原水处理成自来水的工艺流程示意图:
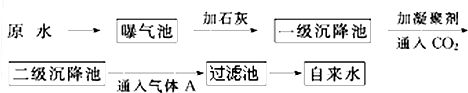
①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个): ; .
②FeSO4?7H2O是常用的凝聚剂,它在水中最终生成 沉淀;通入二氧化碳的目的是 和 .
③气体A的作用是 ,通常可以用Ca(ClO)2 替代A,下列物质中 同样可以作为气体A的代用品(填编号,多选倒扣).
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2.
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
| pH | Ca2+、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | <0.0045mol?L-1? | <100个?mL-1? |

①原水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):
②FeSO4?7H2O是常用的凝聚剂,它在水中最终生成
③气体A的作用是
a.ClO2 b.浓氨水 c.K2FeO4 d.SO2.
考点:物质分离和提纯的方法和基本操作综合应用,化学反应的基本原理
专题:化学应用
分析:(1)A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气,二氧化碳在溶液中溶解量少,生成碳酸氢钠少;
B.在硫酸工业中二氧化硫可以循环利用、合成氨工业中氢气、氮气可以循环利用、硝酸工业中一氧化氮可以循环利用,皆采用循环操作提高原料利用率;
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室;
D.氯化铝是共价化合物,工业上不能采用电解熔融氯化铝的方法制取金属铝;
E.石油裂化属于化学变化,主要目的是得到相对分子量小的烃,裂解是为了获得短链不饱和气态烃;
(2)①加入氢氧化钙会沉淀镁离子生成氢氧化镁沉淀,可以和碳酸氢根离子反应生成碳酸根离子和水;
②绿矾水解生成氢氧化亚铁,在空气中迅速被氧化为氢氧化铁,氢氧化铁胶体具有吸附悬浮杂质的主要作用;絮凝剂在原水处理流程中的作用是吸附水中悬浮杂质使之沉降;通入CO2的目的是除去过量的Ca(OH)2和调节pH;
③气体A是氯气利用和水反应生成的次氯酸杀菌消毒;可以利用氧化性的物质进行净水杀菌消毒.
B.在硫酸工业中二氧化硫可以循环利用、合成氨工业中氢气、氮气可以循环利用、硝酸工业中一氧化氮可以循环利用,皆采用循环操作提高原料利用率;
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室;
D.氯化铝是共价化合物,工业上不能采用电解熔融氯化铝的方法制取金属铝;
E.石油裂化属于化学变化,主要目的是得到相对分子量小的烃,裂解是为了获得短链不饱和气态烃;
(2)①加入氢氧化钙会沉淀镁离子生成氢氧化镁沉淀,可以和碳酸氢根离子反应生成碳酸根离子和水;
②绿矾水解生成氢氧化亚铁,在空气中迅速被氧化为氢氧化铁,氢氧化铁胶体具有吸附悬浮杂质的主要作用;絮凝剂在原水处理流程中的作用是吸附水中悬浮杂质使之沉降;通入CO2的目的是除去过量的Ca(OH)2和调节pH;
③气体A是氯气利用和水反应生成的次氯酸杀菌消毒;可以利用氧化性的物质进行净水杀菌消毒.
解答:
解:(1)A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气,二氧化碳在溶液中溶解量少,生成碳酸氢钠少,应先通入氨气再通入二氧化碳,故A错误;
B.在硫酸工业中二氧化硫可以循环利用、合成氨工业中氢气、氮气可以循环利用、硝酸工业中一氧化氮可以循环利用,皆采用循环操作提高原料利用率,故B正确;
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室,阳极室生成氯气,阴极室生成氢气和氢氧化钠,故C正确;
D.氯化铝是共价化合物,工业上不能采用电解熔融氯化铝的方法制取金属铝,应电解熔融的氧化铝制备,故D错误;
E.石油裂化属于化学变化,主要目的是得到相对分子量小的烃,裂解是为了获得短链不饱和气态烃,故E错误;
故答案为:BC;
(2)①加入氢氧化钙会沉淀镁离子生成氢氧化镁沉淀,可以和碳酸氢根离子反应生成碳酸根离子和水,反应的离子方程式为:HCO3-+OH-═COO32-+H2O,Mg2++2OH-═Mg(OH)2↓,故答案为:HCO3-+OH-═COO32-+H2O,Mg2++2OH-═Mg(OH)2↓,
②绿矾水解生成氢氧化亚铁,在空气中迅速被氧化为氢氧化铁,氢氧化铁胶体具有吸附悬浮杂质的主要作用;絮凝剂在原水处理流程中的作用是吸附水中悬浮杂质使之沉降;通入CO2的目的是除去过量的Ca(OH)2和调节pH,故答案为:胶状Fe(OH)3;除去Ca2+;调节pH;
③气体A是氯气,目的是氯气和水反应生成的次氯酸具有强氧化性,能杀菌消毒,替代物质需要具备氧化性的物质才能起到消毒杀菌,
a.ClO2 具有氧化性可以替代氯气消毒杀菌,故a正确;
b.浓氨水是一元弱碱溶液,不能杀菌消毒,故b错误;
c.K2FeO4 是高铁酸钾具有氧化性能起到杀菌消毒的作用,故c正确;
d.SO2是有毒气体,具有弱氧化性,不能用来杀菌消毒,故d错误;
故答案为:杀菌消毒;ac.
B.在硫酸工业中二氧化硫可以循环利用、合成氨工业中氢气、氮气可以循环利用、硝酸工业中一氧化氮可以循环利用,皆采用循环操作提高原料利用率,故B正确;
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室,阳极室生成氯气,阴极室生成氢气和氢氧化钠,故C正确;
D.氯化铝是共价化合物,工业上不能采用电解熔融氯化铝的方法制取金属铝,应电解熔融的氧化铝制备,故D错误;
E.石油裂化属于化学变化,主要目的是得到相对分子量小的烃,裂解是为了获得短链不饱和气态烃,故E错误;
故答案为:BC;
(2)①加入氢氧化钙会沉淀镁离子生成氢氧化镁沉淀,可以和碳酸氢根离子反应生成碳酸根离子和水,反应的离子方程式为:HCO3-+OH-═COO32-+H2O,Mg2++2OH-═Mg(OH)2↓,故答案为:HCO3-+OH-═COO32-+H2O,Mg2++2OH-═Mg(OH)2↓,
②绿矾水解生成氢氧化亚铁,在空气中迅速被氧化为氢氧化铁,氢氧化铁胶体具有吸附悬浮杂质的主要作用;絮凝剂在原水处理流程中的作用是吸附水中悬浮杂质使之沉降;通入CO2的目的是除去过量的Ca(OH)2和调节pH,故答案为:胶状Fe(OH)3;除去Ca2+;调节pH;
③气体A是氯气,目的是氯气和水反应生成的次氯酸具有强氧化性,能杀菌消毒,替代物质需要具备氧化性的物质才能起到消毒杀菌,
a.ClO2 具有氧化性可以替代氯气消毒杀菌,故a正确;
b.浓氨水是一元弱碱溶液,不能杀菌消毒,故b错误;
c.K2FeO4 是高铁酸钾具有氧化性能起到杀菌消毒的作用,故c正确;
d.SO2是有毒气体,具有弱氧化性,不能用来杀菌消毒,故d错误;
故答案为:杀菌消毒;ac.
点评:本题以净化水为中心,考查了过滤操作、硬水和软水的转化方法以及物理变化和化学变化的判断,解题时要针对结合所学习的基础知识,经过仔细分析后再作回答.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
在溶液中能大量共存的离子组是( )
| A、H+、CO32-、Na+ |
| B、NH4+、K+、OH- |
| C、Ag+、Cl-、Na+ |
| D、Na+、NO3-、Cu2+ |
下列方程式中,正确的是( )
| A、CH3COOH在水中电离:CH3COOH═H++CH3COO- | |||
| B、金属Na投入水中:2Na+2H2O═2Na++2OH-+H2↑ | |||
C、乙酸与乙醇发生酯化反应:CH3COOH+C2H5OH
| |||
| D、稀硫酸中加入碳酸氢钠固体:H++NaHCO3═H2O+CO2↑+Na+ |
下列各组物质中物质的量最多的是( )
| A、0.5molCO2 |
| B、常温常压下48gO2 |
| C、标准状况下22.4LH2 |
| D、2NA个水分子 |
燃烧0.2mol某有机物,得到0.4molCO2和10.8g H2O,由此可得出结论是( )
| A、该有机物含有2个碳原子和6个氢原子 |
| B、该有机物中碳元素和氢元素的原子个数比为3:1 |
| C、该有机物中含有2个CO2和3个H2O |
| D、该有机物的1个分子里含有2个碳原子和6个氢原子,可能含有氧原子 |
用铂电极(惰性电极)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
| A、NaCl溶液 |
| B、HCl溶液 |
| C、Na2SO4溶液 |
| D、AgNO3溶液 |
下列叙述正确的是( )
| A、pH=3的酸溶液稀释100倍后pH=5 |
| B、相同温度下,pH=3的溶液和pH=5的溶液相比,前者氢离子浓度是后者的100倍 |
| C、相同温度相同浓度的钾盐溶液中,酸式盐的pH一定小于正盐的pH |
| D、碳酸钠溶液在室温时的pH一定大于60℃时的pH |

 )的一条路线如下:
)的一条路线如下: