题目内容
16.在一密封容器中,1mol CO和2mol O2发生反应,生成1mol CO2,求容器中C、O的原子个数比:1:5.分析 1mol CO和2molO2发生反应,根据原子守恒,不管产物以及量的多少,容器中氧原子都是5mol,碳原子都是1mol,根据N=nNA来计算回答.
解答 即:1mol CO和2molO2发生反应,根据原子守恒,不管产物以及量的多少,容器中氧原子都是5mol,碳原子都是1mol,根据N=nNA,原子数目之比等于原子的物质的量之比,即容器中C、O的原子个数比是1:5.
故答案为:1:5.
点评 本题考查学生物质的量有关计算知识,解题的关键是注意原子守恒在反应中的应用,难度中等.

练习册系列答案
相关题目
7.对于反应A+B-→C,如果温度每升高10℃,反应速率增加为原来的3倍.在10℃时,完成反应的20%需要54min;将温度提高到40℃,完成反应的20%需要的时间为( )
| A. | 2 min | B. | 3 min | C. | 6 min | D. | 9 min |
4.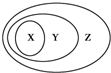 下表所列的一些物质或概念间的从属关系中,不符合图示要求的是( )
下表所列的一些物质或概念间的从属关系中,不符合图示要求的是( )
 下表所列的一些物质或概念间的从属关系中,不符合图示要求的是( )
下表所列的一些物质或概念间的从属关系中,不符合图示要求的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 碱 | 电解质 | 化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 酸性氧化物 | 非金属氧化物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A. | A | B. | B | C. | C | D. | D |
11.以下反应会导致溶液导电性减弱的是( )
| A. | Na2S04溶液加人BaCl2固体 | B. | Ba(0H)2溶液中加人CuS04(少量)固体 | ||
| C. | Na0H溶液通人HCl | D. | H2O中加人NaCl固体 |
8.1,2-二溴乙烷可作汽油抗爆剂的添加剂,下图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).

有关数据列表如下:
请按要求回答下列问题:
(1)实验开始之前必要的操作是检查装置的气密性.
(2)A中反应的化学方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(3)实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是停止加热,向烧杯E中加适量温水.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发.
(6)判断该制备反应已经结束的最简单方法是装置E中小试管内的液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出(答出其中两条即可).

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体[ | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
(1)实验开始之前必要的操作是检查装置的气密性.
(2)A中反应的化学方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(3)实验过程中,若发现装置B中水沿导管G上升,则需进行的操作是停止加热,向烧杯E中加适量温水.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发.
(6)判断该制备反应已经结束的最简单方法是装置E中小试管内的液体由红棕色变为无色;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是有副反应发生或反应过于剧烈,一部分乙烯没有充分反应就逸出(答出其中两条即可).
6.把1mol饱和一元醇分成两等份,其中一份充分燃烧生成1.5molCO2,另一份与金属钠充分作用,在标准状况下生成5.6LH2,该醇可能是( )
| A. | CH3CH2OH | B. | CH3CH2CH2OH | C. | CH3OH | D. | CH3CH2CH(CH3)OH |
 .
.




