题目内容
15.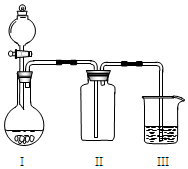 实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和表中提供的物质完成相关实验,其中合理的选项是( )
实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和表中提供的物质完成相关实验,其中合理的选项是( )| 选项 | I中的物质 | II中收集的气体 | III中的物质 |
| A | Cu和浓硝酸 | NO | NaOH溶液 |
| B | 浓盐酸和高锰酸钾 | Cl2 | NaOH溶液 |
| C | 大理石和稀硫酸 | CO2 | 澄清石灰水 |
| D | 浓氨水和CaO | NH3 | 滴加酚酞的水 |
| A. | A | B. | B | C. | C | D. | D |
分析 由实验装置可知,I为固体与液体的反应生成气体,II中为向上排空气法收集气体,III中吸收过量的气体,以此来解答.
解答 解:A.Cu和浓硝酸反应生成NO2,故A不选;
B.浓盐酸和高锰酸钾反应生成Cl2,Cl2的密度比空气大,可与NaOH反应,气体的制取、收集、尾气处理均合理,故B选;
C.大理石和稀硫酸反应生成硫酸钙微溶,包裹在碳酸钙的表面阻止反应的发生,故C不选;
D.NH3的密度比空气的密度小,应选向下排空气法收集,故D不选;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握气体的制备实验、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
5.磁流体是电子材料的新秀.将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55nm的磁流体.下列说法中正确的是( )
| A. | 所得的分散系属于悬浊液 | |
| B. | 用光束照射该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中分散质为Fe2O3 | |
| D. | 分散系为胶体,胶粒直径即Fe(OH)3分子直径 |
6.间甲乙苯苯环上的一个氢原子被-C3H7Cl取代,形成的同分异构体有(不考虑立体异构)( )
| A. | 9种 | B. | 12种 | C. | 15种 | D. | 20种 |
3.下列离子方程式书写正确的是( )
| A. | 向酸性KlO3溶液中加入KI溶液:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | FeS除去污水中的微量Hg2+:FeS+Hg2+═HgS+Fe2+ | |
| C. | NaHCO3溶液呈碱性:HCO3-+H2O?CO32--+H3O+ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
10.下列对实验室突发事件的处理,合理的是( )
| A. | 日光灯管破碎,只需收集散落的汞即可 | |
| B. | 金属镁失火,应采用泡沫灭火器灭火 | |
| C. | 钡离子中毒,可以通过服用碳酸钠溶液解毒 | |
| D. | 烧碱溶液溅到皮肤上,应立即用大量的水冲洗 |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使石蕊显红色的溶液:K+、Mg2+、HCO3-、SO42- | |
| B. | 水电离出来的 c(H+)=10-13mol•L-1的溶液:NH4+、Fe2+、NO3-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:K+、Fe3+、Cl-、SO42- | |
| D. | 加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO42- |
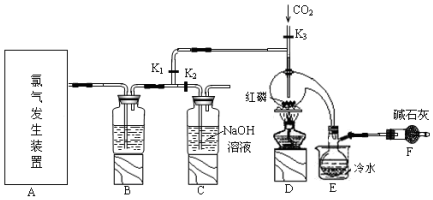
7.三氯化磷(PCl3)是一种用于有机合成的重要催化剂.实验室常用红磷与干燥的Cl2制取PCl3,装置如图所示.
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
请答下面问题:
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿;,然后稍稍用力即可把玻璃管插入橡皮管.
(2)B中所盛试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(3)实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷与空气中的氧气发生自燃,C装置中的K1、K2的设计也出于类似的目的,为了达到这-实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(4)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为82.5%.
4.有关氯化钠叙述错误的是( )
| A. | 是强电解质 | B. | 固体能导电 | ||
| C. | 电子式为: | D. | 25℃时,溶液的pH=7 |
9.下列各组物质的溶液中,不需要外加试剂就能鉴别的一组是( )
| A. | FeCl3、Fe2(SO4)3、Fe(NO3)3、FeBr3 | B. | FeCl3、Na2CO3、NaOH、NaCl | ||
| C. | FeSO4、MgSO4、Na2SO4、H2O2 | D. | FeCl2、NH4Cl、MgCl2、KCl |