题目内容
【题目】甲、乙两烧瓶中各盛有100mL 5mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A.2.7gB.3.6gC.5.4gD.6.75g
【答案】D
【解析】
铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为甲:乙=2:3,由方程式:![]() 、
、![]() ,可知相同物质的量的Al反应时,消耗HCl较多,故酸与金属反应时酸不过量,碱与金属反应时碱过量,结合方程式计算解答.
,可知相同物质的量的Al反应时,消耗HCl较多,故酸与金属反应时酸不过量,碱与金属反应时碱过量,结合方程式计算解答.
盐酸与铝的离子反应式为:![]() ,KOH与铝的离子反应式为:
,KOH与铝的离子反应式为:![]() ,所以等物质的量的铝分别与足量的盐酸和氢氧化钾溶液反应,消耗的氢氧化钾溶液的量比盐酸少;而本题中反应结束测得生成的气体体积甲∶乙=2∶3,故盐酸少量,则与盐酸反应生成的氢气为
,所以等物质的量的铝分别与足量的盐酸和氢氧化钾溶液反应,消耗的氢氧化钾溶液的量比盐酸少;而本题中反应结束测得生成的气体体积甲∶乙=2∶3,故盐酸少量,则与盐酸反应生成的氢气为![]() ,故与KOH溶液反应生成的氢气为
,故与KOH溶液反应生成的氢气为![]() 。KOH溶液足量,加入其中的铝完全反应。故可求得
。KOH溶液足量,加入其中的铝完全反应。故可求得![]() 。
。
综上所述,本题正确答案为D。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】某组甲乙同学进行稀硫酸与锌制取氢气的实验,请回答下列问题:
(1)甲同学发现加入少量硫酸铜溶液可加快氢气的生成速率。为了进一步研究硫酸铜的量对氢气生成速率的影响,设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=___,V6=___,V9=___;
②反应一段时间后,实验A中的金属呈___色,实验E中的金属呈___色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___________________________。
(2)乙同学为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。
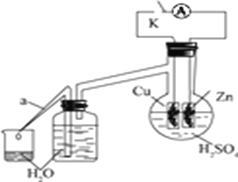
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是__________________________________________________________。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是____________________________________。
【题目】(1)25 ℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合。
①若所得溶液的pH=11,且a=13,b=2,则Va∶Vb=____________。
②为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg![]() 。25 ℃时,若溶液呈中性,则AG=___,溶液的pH与AG的换算公式为AG=_____。
。25 ℃时,若溶液呈中性,则AG=___,溶液的pH与AG的换算公式为AG=_____。
(2)常温下,浓度均为0.1molL-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合H+能力最强的是____。
②根据表中数据,浓度均为0.01 molL-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是__(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:_______;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为__mol/L。