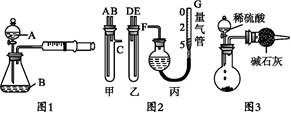
ΧβΡΩΡΎ»ί
Νρ¥ζΝρΥαΡΤΒΡ¥ΩΕ»Ω…”ΟΒΈΕ®Ζ®Ϋχ––≤βΕ®Θ§‘≠άμ «ΘΚ2S2O32Θ≠+ I2 Γζ S4O62Θ≠+ 2I-
38.≈δ÷Τ100 mL0.0500 mol/L I2»ή“ΚΘ§≤Μ–η“ΣΒΡ“«Τς « Θ®―ΓΧν±ύΚ≈Θ©ΓΘ
aΘ°100 mL»ίΝΩΤΩ bΘ°ΝΩΆ≤ cΘ°…’±≠ dΘ°≤ΘΝßΑτ
ΒΈΕ®Ιή±ξ”– Ι”ΟΈ¬Ε»ΘΚ20oC; ΒΈΕ®ΙήΒΡΉν–ΓΩΧΕ»ΈΣ mLΓΘ
39.»Γ2 .500gΚ§‘”÷ ΒΡNa2S2O3ΓΛ5H2OΨßΧε≈δ≥…50mL»ή“ΚΘ§ΟΩ¥Έ»Γ10.00mLΖ≈»κΉΕ–ΈΤΩάοΘ§Φ”2ΒΈΒμΖέΈΣ÷Η ΨΦΝΘ§‘Ό”Ο0.0500 mol/L I2»ή“ΚΒΈΕ®Θ§ Β―ι ΐΨί»γœ¬(ΒΎ3¥Έ≥θΕΝ ΐΈΣ 0.00Θ§÷’ΒψΕΝ ΐ»γΆΦ; ‘”÷ ≤Μ≤ΈΦ”Ζ¥”Π)ΘΚ
| ±ύΚ≈ | 1 | 2 | 3 |
| œϊΚΡI2»ή“ΚΒΡΧεΜΐ/mL | 19.98 | 20.02 | |
Na2S2O3?5H2O( ΫΝΩ248)ΒΡ÷ ΝΩΖ÷ ΐ «Θ®±ΘΝτ4ΈΜ–Γ ΐΘ© ΓΘ
40.Μα‘λ≥… Β―ιΫαΙϊΤΪΒΆΒΡ≤ΌΉς « Θ®―ΓΧν±ύΚ≈Θ©ΓΘ
a. ΒΈΕ® ±ΒΈΕ®Ιή÷–ΒΡ“ΚΧεΒΈ‘ΎΉΕ–ΈΤΩΆβ
b. ΉΕ–ΈΤΩ”Ο’τΝσΥ°œ¥ΨΜΚσΘ§ΝΔΦ¥ΉΑ»κ¥ΐ≤β»ή“Κ
c. Έ¥”Ο±ξΉΦ“Κ»σœ¥ΒΈΕ®Ιή
d. ’ώΒ¥ ±»ή“ΚΫΠ≥ωΉΕ–ΈΤΩΆβ
38.bΘ®1Ζ÷Θ©ΘΜ0.1Θ®1Ζ÷Θ©.
39.»ή“Κ”…Έό…Ϊ±δΈΣάΕ…ΪΘ§«“ΑκΖ÷÷”ΡΎ≤ΜΆ »ΞΘ®1Ζ÷Θ§≤Μ¥π»Ϊ≤ΜΗχΖ÷Θ©ΘΜ0.9920Μρ99.20%Θ®1Ζ÷Θ©.
40.dΘ®1Ζ÷Θ©
ΫβΈω ‘ΧβΖ÷ΈωΘΚ38.≈δ÷Τ100 mL0.0500 mol/L I2»ή“ΚΘ§I2–η“Σ≥ΤΝΩΘ§≤Μ–η“ΣΒΡ“«Τς «ΝΩΆ≤ΓΘΒΈΕ®ΙήΒΡΉν–ΓΩΧΕ»ΈΣ0.1mLΓΘ
39.÷Η ΨΦΝΈΣΒμΖέΘ§”ωI2±δάΕΘ§Ι ΒΫ¥οΒΈΕ®÷’ΒψΒΡœ÷œσ «»ή“Κ”…Έό…Ϊ±δΈΣάΕ…ΪΘ§«“ΑκΖ÷÷”ΡΎ≤ΜΆ »ΞΓΘ
»Γ2 .500gΚ§‘”÷ ΒΡNa2S2O3ΓΛ5H2OΨßΧε≈δ≥…50mL»ή“ΚΘ§ΟΩ¥Έ»Γ10.00mLΖ≈»κΉΕ–ΈΤΩάοΘ§―υΤΖΈΣ0.500gΘΜΒΎ3¥ΈΕύ ΐΈΣ20.10mLΘ§ ΐ÷Β”κ«ΑΝΫ¥Έœύ≤νΫœ¥σΘ§…α»ΞΓΘ
”…2S2O32Θ≠+ I2 Γζ S4O62Θ≠+ 2I-
n(Na2S2O3ΓΛ5H2O)=2n(I2)=2ΓΝ0.0500 mol/LΓΝ ΓΝ10-3L=0.002mol
ΓΝ10-3L=0.002mol
Ι ΠΊ(Na2S2O3ΓΛ5H2O)=  ΓΝ100%=99.2%ΓΘ
ΓΝ100%=99.2%ΓΘ
40.aΘ°ΒΈΕ® ±ΒΈΕ®Ιή÷–ΒΡ“ΚΧεΒΈ‘ΎΉΕ–ΈΤΩΆβΘ§ΒΈΕ®ΕΝ ΐΤΪ¥σΘ§ Β―ιΫαΙϊΗΏΘΜbΘ°ΉΕ–ΈΤΩ”Ο’τΝσΥ°œ¥ΨΜΚσΘ§ΝΔΦ¥ΉΑ»κ¥ΐ≤β»ή“ΚΘ§Na2S2O3ΒΡΦΤΝΩ≤Μ±δΘ§ Β―ιΈόΈσ≤νΘΜcΘ°Έ¥”Ο±ξΉΦ“Κ»σœ¥ΒΈΕ®ΙήΘ§“ρΒΈΕ®ΙήΡΎ±ΎΗΫ”–Υ°Θ§Φ”»κΒΡ±ξΉΦ“Κ±ΜœΓ ΆΘ§Ι ΒΈΕ®–η“ΣΒΡΧεΜΐΤΪ¥σΘ§ Β―ιΫαΙϊΗΏΘΜdΘ°’ώΒ¥ ±»ή“ΚΫΠ≥ωΉΕ–ΈΤΩΆβΘ§Na2S2O3±ΜΥπ ßΘ§ΒΈΕ®–η“ΣΒΡ±ξΉΦ“ΚΧεΜΐΤΪ–ΓΘ§ Β―ιΫαΙϊΒΆΓΘ
ΩΦΒψΘΚΒΈΕ® Β―ι‘≠άμ”Π”Ο”κΦΤΥψΓΘ

œ¬Ν–ΙΊ”Ύ―–ΨΩΈο÷ –‘÷ ΒΡΜυ±Ψ≥Χ–ρΘ§≈≈Ν–Υ≥–ρ’ΐ»Ζ «Θ® Θ©
aΙέ≤λΈο÷ ΒΡΆβΙέ–‘÷ Θ§b Β―ιΚΆΙέ≤λΘ§cΫβ ΆΦΑΫα¬έΘ§d‘Λ≤βΈο÷ ΒΡ–‘÷
| AΘ°bacd | BΘ°abcd | CΘ°adbc | DΘ°dabc |
”–ΙΊνήΚΆΧζΜ·ΚœΈοΒΡ–‘÷ Φϊœ¬±μΘΚ
| Μ·―ß Ϋ | »ήΕ»ΜΐΘ® “Έ¬ ±Θ©Ksp | ≥ΝΒμΆξ»Ϊ ±ΒΡpH | ¬»Μ·νήΨßΧεΒΡ–‘÷ |
| Co(OH) 2 | 5.9ΓΝ10-15 | 9.4 | CoCl2ΓΛ6H2O≥ Κλ…ΪΘ§≥ΘΈ¬œ¬Έ»Ε®ΓΘ110ºCΓΪ120ºC ±Ά―Υ°±δ≥…άΕ…ΪΈόΥ°¬»Μ·νή |
| Fe(OH) 2 | 1.6ΓΝ10-14 | 9.6 | |
| Fe(OH) 3 | 1.0ΓΝ10-35 | x |
”ΟΚ§νήΖœΝœΘ®Κ§…ΌΝΩΧζΘ©Ω…÷Τ±Η¬»Μ·νήΘΚCo+2HCl=CoCl2+H2ΓϋΙΛ“’Νς≥Χ»γœ¬ΘΚ
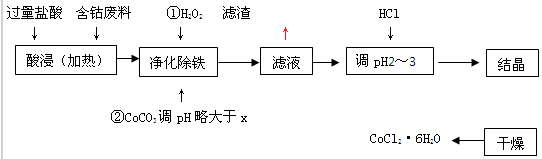
‘ΜΊ¥πΘΚ
Θ®1Θ©ΓΑΨΜΜ·≥ΐΧζΓ±÷–Θ§–¥≥ωΦ”»κCoCO3Θ®Ρ―»ήΘ©ΒςpH ±Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ
Θ®2Θ©¬Υ“Κ÷–Θ®Fe3+Θ©Γή1.0ΓΝ10-5mol/L ±Θ§Ω… ”ΈΣFe3+≥ΝΒμΆξ»ΪΓΘ ‘ΦΤΥψ “Έ¬œ¬Θ§Fe(OH) 3≥ΝΒμΆξ»Ϊ ±Θ§‘ρx= ΓΘ
Θ®3Θ©ΔΎ≤Ϋ÷–”ΟCoCO3ΒςpH¬‘¥σ”ΎxΒΡ‘≠“ρ « ΓΘ
Θ®4Θ©¬Υ“Κ÷–ΥυΚ§»ή÷ ”– Θ§ ΓΘ
Θ®5Θ©ΈΣΝΥΖά÷ΙCoCl2ΓΛ6H2OΆ―Υ°Θ§ΓΑΗ…‘οΓ± ±“Υ≤…”ΟΒΡΖΫΖ®Μρ≤ΌΉς « Θ§ ΓΘ
Θ®15Ζ÷Θ©
Ρ≥Μ·―ß–Υ»Λ–ΓΉιΒΡΆ§―ßΈΣ÷Τ»Γ…ΌΝΩδε““ΆιΘ§≤ι‘ΡΉ ΝœΒΟ÷ΣΘΚ
NaBrΘΪH2SO4 HBrΘΪNaHSO4
HBrΘΪNaHSO4
CH3CH2OHΘΪHBr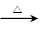 CH3CH2BrΘΪH2O
CH3CH2BrΘΪH2O
Μ·―ß–Υ»Λ–ΓΉιΗυΨί Β―ι‘≠άμ…ηΦΤ»γ”“ΆΦΒΡΉΑ÷ΟΓΘ
ΗυΨίΧβ“βΆξ≥…œ¬Ν–ΧνΩ’ΘΚ”–ΙΊ ΐΨίΝ–±μ»γœ¬ΘΚ
| | ““¥Φ | δε““Άι |
| Ή¥Χ§ | Έό…Ϊ“ΚΧε | Έό…Ϊ“ΚΧε |
| ΟήΕ»Θ·g ΓΛ cm-3 | 0.8 | 1.4 |
| Ζ–ΒψΘ·Γφ | 78.5 | 119.0 |
| »έΒψΘ·Γφ | -l30 | 38.4 |
Θ®1Θ©‘≤ΒΉ…’ΤΩ÷–Φ”»κΒΡΖ¥”ΠΈο «δεΜ·ΡΤΓΔ ΚΆ2:1ΒΡΝρΥαΓΘ≈δ÷ΤΧεΜΐ±»2ΘΚ1ΒΡΝρΥαΥυ”ΟΒΡ“«ΤςΈΣ (―ΓΧν±ύΚ≈Θ©
aΘ°…’±≠ bΘ°≤ΘΝßΑτ cΘ°ΝΩΆ≤ dΘ°»ίΝΩΤΩ e.ΒΈΕ®Ιή
Θ®2Θ©ΫΪ…ζ≥…ΈοΒΦ»κ Δ”–±υΥ°ΜλΚœΈοΒΡ ‘ΙήA÷–Θ§ ‘ΙήA÷–ΒΡΈο÷ Ζ÷ΈΣ»ΐ≤ψΘ®»γΆΦΥυ ΨΘ©Θ§≤ζΈο‘ΎΒΎ
≤ψΘΜ
Θ®3Θ©”Ο≈®ΒΡΝρΥαΫχ–– Β―ιΘ§»τ ‘ΙήA÷–ΜώΒΟΒΡ”–ΜζΈο≥ ΉΊΜΤ…ΪΘ§≥ΐ»ΞΤδ÷–‘”÷ ”ΠΦ”
»κ (―ΓΧν±ύΚ≈Θ©»ΜΚσ‘ΌΫχ–– “Μ≤Ϋ≤ΌΉςΦ¥Ω…ΘΜ
aΘ°ΈόΥ°¬»Μ·ΗΤ bΘ°œθΥα“χ»ή“Κ cΘ°ΥΡ¬»Μ·ΧΦ dΘ°―«ΝρΥαΡΤ»ή“Κ
Θ®4Θ© Β―ιΙΐ≥Χ÷–Θ§Ά§―ßΖΔœ÷“«ΤςΝ§Ϋ”≤ΩΖ÷”–¬©Τχœ÷œσΘ§άœ ΠΫ®“ιΑ―…œ ωΉΑ÷Ο÷–ΒΡ“«ΤςΝ§Ϋ”≤ΩΖ÷ΕΦΗΡ≥…±ξΉΦ≤ΘΝßΫ”ΩΎΘ§Τδ‘≠“ρ «ΘΚ ΘΜ
Θ®5Θ©ΦΌ…ηΉν≥θ»Γ”ΟΒΡΈόΥ°““¥Φ «57.5mL,ΉνΚσΒΟΒΫΒΡ¥ΩΨΜΒΡδε““Άι «52.0mLΘ§‘ρδε““ΆιΒΡ≤ζ¬ ΈΣ ΓΘ
Υα–‘KMnO4»ή“ΚΡή”κ≤ίΥαΘ®H2C2O4Θ©»ή“ΚΖ¥”ΠΓΘΡ≥ΧΫΨΩ–ΓΉιάϊ”ΟΖ¥”ΠΙΐ≥Χ÷–»ή“ΚΉœ…Ϊœϊ ßΩλ¬ΐΒΡΖΫΖ®ά¥―–ΨΩ”ΑœλΖ¥”ΠΥΌ¬ ΒΡ“ρΥΊΓΘ
Δώ. Β―ι«Α Ήœ»”Ο≈®Ε»ΈΣ0.1000mol?L-1Υα–‘KMnO4±ξΉΦ»ή“ΚΒΈΕ®Έ¥÷Σ≈®Ε»ΒΡ≤ίΥαΓΘ
Θ®1Θ©–¥≥ωΒΈΕ®Ιΐ≥Χ÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ ΓΘ
Θ®2Θ©ΒΈΕ®Ιΐ≥Χ÷–≤ΌΉςΒΈΕ®ΙήΒΡΆΦ Ψ’ΐ»ΖΒΡ « ΓΘ
Θ®3Θ©»τΒΈΕ®«ΑΒΈΕ®ΙήΦβΉλ¥Π”–Τχ≈ίΘ§ΒΈΕ®Κσœϊ ßΘ§Μα Ι≤βΒΟΒΡ≤ίΥα»ή“Κ≈®Ε»
Θ®ΧνΓΑΤΪΗΏΓ±ΓΔΓΑΤΪΒΆΓ±ΓΔΜρΓΑ≤Μ±δΓ±Θ©ΓΘ
Δρ.Ά®ΙΐΒΈΕ® Β―ιΒΟΒΫ≤ίΥα»ή“ΚΒΡ≈®Ε»ΈΣ0.2000molΓΛL-1 ΓΘ”ΟΗΟ≤ίΥα»ή“ΚΑ¥œ¬±μΫχ––Κσ–χ Β―ιΘ®ΟΩ¥Έ Β―ι≤ίΥα»ή“ΚΒΡ”ΟΝΩΨυΈΣ8mLΘ©ΓΘ
| Β―ι±ύΚ≈ | Έ¬Ε»Θ®ΓφΘ© | ¥ΏΜ·ΦΝ ”ΟΝΩ(g) | Υα–‘ΗΏΟΧΥαΦΊ»ή“Κ | Β―ιΡΩΒΡ a. Β―ι1ΚΆ2ΧΫΨΩ ΘΜ b. Β―ι1ΚΆ3ΧΫΨΩΖ¥”ΠΈο≈®Ε»Ε‘ΗΟΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΘΜ c. Β―ι1ΚΆ4ΧΫΨΩ¥ΏΜ·ΦΝΕ‘ΗΟΖ¥”ΠΥΌ¬ ΒΡ”ΑœλΓΘ | |
| ΧεΜΐ Θ®mLΘ© | ≈®Ε» (mol?L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
Θ®4Θ©–¥≥ω±μ÷–a Ε‘”ΠΒΡ Β―ιΡΩΒΡ ΘΜ»τ50ΓψC ±Θ§≤ίΥα≈®Ε»c(H2C2O4)ΥφΖ¥”Π ±ΦδtΒΡ±δΜ·«ζœΏ »γœ¬ΆΦΥυ ΨΘ§±Θ≥÷ΤδΥϊΧθΦΰ≤Μ±δΘ§«κ‘ΎΆΦ÷–Μ≠≥ω25ΓψC ±c(H2C2O4)ΥφtΒΡ±δΜ·«ζœΏ Ψ“βΆΦΓΘ

Θ®5Θ©ΗΟ–ΓΉιΆ§―ßΕ‘ Β―ι1ΚΆ3Ζ÷±πΫχ––ΝΥ»ΐ¥Έ Β―ιΘ§≤βΒΟ“‘œ¬ Β―ι ΐΨίΘ®¥”ΜλΚœ’ώΒ¥Ψυ‘»ΩΣ ΦΦΤ ±Θ©ΘΚ
| Β―ι±ύΚ≈ | »ή“ΚΆ …ΪΥυ–η ±ΦδΘ®minΘ© | ||
| ΒΎ1¥Έ | ΒΎ2¥Έ | ΒΎ3¥Έ | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
Θ®6Θ©ΗΟ Β―ι÷– Ι”ΟΒΡ¥ΏΜ·ΦΝ”Π―Γ‘ώMnSO4Εχ≤Μ «MnCl2Θ§‘≠“ρΩ…”ΟάκΉ”ΖΫ≥Χ Ϋ±μ ΨΈΣ ΓΘ
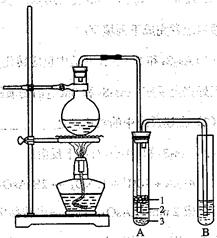
(12Ζ÷)ΈΣ―ι÷Λ―θΜ·–‘ΘΚCl2>Fe3+>SO2Θ§Ρ≥–ΓΉι”Οœ¬ΆΦΥυ ΨΉΑ÷ΟΫχ–– Β―ι(Φ–≥÷“«ΤςΚΆA÷–ΒΡΦ”»»ΉΑ÷Ο“―¬‘Θ§ΤχΟή–‘“―Ψ≠Φλ―ιΆξ±œ) Β―ιΙΐ≥Χ»γœ¬ΘΚ
ΔώΘ°¥ρΩΣΒ·Μ…Φ–K1ΓΪK4Θ§Ά®»κ“ΜΕΈ ±ΦδN2Θ§‘ΌΫΪT–ΆΒΦΙή≤ε»κB÷–Θ§ΦΧ–χΆ®»κN2Θ§»ΜΚσΙΊ±’K1ΓΔK3ΓΔK4Θ°
ΔρΘ°¥ρΩΣΜν»ϊaΘ§ΒΈΦ”“ΜΕ®ΝΩΒΡ≈®―ΈΥαΘ§ΗχAΦ”»»Θ°
ΔσΘ°Β±B÷–ΒΡ»ή“Κ±δΜΤ ±Θ§ΆΘ÷ΙΦ”»»Θ§Φ–ΫτΒ·Μ…Φ–K2Θ°
ΔτΘ°¥ρΩΣΜν»ϊbΘ§ Ι‘Φ2mlΒΡ»ή“ΚΝς»κD ‘Ιή÷–Θ§Φλ―ιΤδ÷–ΒΡάκΉ”Θ°
VΘ°¥ρΩΣΒ·Μ…Φ–K3ΓΔΜν»ϊcΘ§Φ”»κ70ΘΞΒΡΝρΥαΘ§“ΜΕΈ ±ΦδΚσΦ–ΫτΒ·Μ…Φ–K3Θ°
ΔωΘ°Ηϋ–¬ ‘ΙήDΘ§÷ΊΗ¥Ιΐ≥ΧΔτΘ§Φλ―ιB»ή“Κ÷–ΒΡάκΉ”Θ°
Θ®1Θ©Ιΐ≥ΧΔώΒΡΡΩΒΡ «______________________ΓΘ
Θ®2Θ©ΟόΜ®÷–Ϋΰ»σΒΡ»ή“ΚΈΣ__________________ΓΘ
Θ®3Θ©A÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ__________________________________ΓΘ
Θ®4Θ©”Ο70ΘΞΒΡΝρΥα÷Τ»ΓSO2Θ§Ζ¥”ΠΥΌ¬ ±»”Ο98ΘΞΒΡΝρΥαΩλΘ§‘≠“ρ «______________
Θ®5Θ©Ιΐ≥ΧΔω÷–Φλ―ιB»ή“Κ÷– «ΖώΚ§”–ΝρΥαΗυΒΡ≤ΌΉς «________________________________
Θ®6Θ©ΦΉΓΔ““ΓΔ±ϊ»ΐΈΜΆ§―ßΖ÷±πΆξ≥…ΝΥ…œ ω Β―ιΘ§ΥϊΟ«ΒΡΦλ≤βΫαΙϊ“ΜΕ®ΡήΙΜ÷ΛΟς―θΜ·–‘Cl2>Fe3+>SO2ΒΡ «
| | Ιΐ≥ΧIV B»ή“Κ÷–Κ§”–ΒΡάκΉ” | Ιΐ≥ΧVI B»ή“Κ÷–Κ§”–ΒΡάκΉ” |
| ΦΉ | ”–Fe3+ΈόFe2+ | ”–SO42©¹ |
| ““ | Φ»”–Fe3+”÷”–Fe2+ | ”–SO42©¹ |
| ±ϊ | ”–Fe3+ΈόFe2+ | ”–Fe2+ |
Θ®“ΜΘ©(4Ζ÷)ά®Κ≈÷–ΒΡΈο÷ «‘”÷ Θ§–¥≥ω≥ΐ»Ξ’β–©‘”÷ ΒΡ ‘ΦΝΘΚ
Θ®1Θ©MgO (Al2O3) Θ®2Θ©Cl2(HCl)
Θ®3Θ©FeCl3(FeCl2) Θ®4Θ©NaHCO3»ή“Κ(Na2CO3)
Θ®ΕΰΘ©(6Ζ÷)ΚΘΥ°÷–Κ§”–¥σΝΩΒΡ¬»Μ·ΟΨΘ§¥”ΚΘΥ°÷–Χα»ΓΟΨΒΡ…ζ≤ζΝς≥Χ»γœ¬ΆΦΥυ ΨΘΚ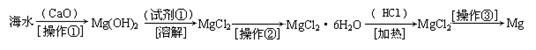
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
–¥≥ω‘ΎΚΘΥ°÷–Φ”»κ―θΜ·ΗΤ…ζ≥…«β―θΜ·ΟΨΒΡΜ·―ßΖΫ≥Χ Ϋ ΘΜ
≤ΌΉςΔΌ÷ς“Σ «÷Η ΘΜ ‘ΦΝΔΌΩ…―Γ”Ο ΘΜ
≤ΌΉςΔΎ «÷Η ΘΜΨ≠≤ΌΉςΔέΉν÷’Ω…ΒΟΫπ τΟΨΓΘ
Θ®»ΐΘ©Θ®8Ζ÷Θ© Β―ι “≈δ÷Τ480ml 0Θ°1molΓΛL-1ΒΡNa2CO3»ή“ΚΘ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©”Π”ΟΆ–≈ΧΧλΤΫ≥Τ»Γ °Υ°ΧΦΥαΡΤΨßΧε gΓΘ
Θ®2Θ©»γΆΦΥυ ΨΒΡ“«Τς≈δ÷Τ»ή“ΚΩœΕ®≤Μ–η“ΣΒΡ « (Χν–ρΚ≈)Θ§±Ψ Β―ιΥυ–η≤ΘΝß“«ΤςEΙφΗώΈΣ mLΓΘ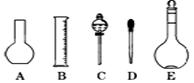
Θ®3Θ©»ίΝΩΤΩ…œ±ξ”–ΘΚΔΌΈ¬Ε»ΓΔΔΎ≈®Ε»ΓΔΔέ»ίΝΩΓΔΔή―Ι«ΩΓΔΔίΩΧΕ»œΏΓΔΔόΥα ΫΜρΦν Ϋ’βΝυœν÷–ΒΡ ΓΘΘ®Χν ΐΉ÷ΖϊΚ≈Θ©
Θ®4Θ©≈δ÷ΤΥυ–ηΒΡ÷ς“Σ“«Τς «ΘΚa»ίΝΩΤΩΓΔb…’±≠ΓΔcΫΚΆΖΒΈΙήΓΔdΆ–≈ΧΧλΤΫΘ§ΥϋΟ«‘Ύ≤ΌΉςΙΐ≥Χ÷– Ι”ΟΒΡ«ΑΚσΥ≥–ρ « ΓΘΘ®Χν–¥Ή÷ΡΗΘ§ΟΩ÷÷“«Τς÷ΜΡή―Γ‘ώ“Μ¥ΈΘ©
Θ®5Θ©≤ΘΝßΑτ «Μ·―ß Β―ι÷–≥Θ”ΟΒΡ“Μ÷÷≤ΘΝßΙΛΨΏΘ§‘ρ‘Ύ≈δ÷Τ»ή“ΚΒΡΙΐ≥Χ÷–≤ΘΝßΑτΙ≤ΤπΒΫΝΥ ÷÷”ΟΆΨΓΘΘ®Χν–¥ ΐΉ÷Θ©
Θ®6Θ©»τ Β―ι ±”ωΒΫœ¬Ν–«ιΩωΘ§ΫΪ Ι»ή“ΚΒΡ≈®Ε»ΤΪΒΆΒΡ « ΓΘ
| AΘ°≈δ÷Τ«ΑΟΜ”–ΫΪ»ίΝΩΤΩ÷–ΒΡΥ°≥ΐΨΓΘΜ |
| BΘ°ΧΦΥαΡΤ ß»ΞΝΥ≤ΩΖ÷ΫαΨßΥ°ΘΜ |
| CΘ°ΧΦΥαΡΤΨßΧε≤Μ¥ΩΘ§Τδ÷–Μλ”–¬»Μ·ΡΤΘΜ |
| DΘ°≥ΤΝΩΧΦΥαΡΤΨßΧε ±Υυ”Ομά¬κ…ζ–βΘΜ |