题目内容
9.已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在Ag+催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸.列说法正确的是( )| A. | 反应中有水参加反应 | |
| B. | 反应后溶液呈无色 | |
| C. | 该反应的还原剂为K2S2O8 | |
| D. | MnSO4和K2S2O8的化学计量数分别为、2 |
分析 根据反应物为硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液,生成物为高锰酸钾、硫酸钾和硫酸,利用质量守恒定律和电子守恒来写出并配平上述反应的化学方程式为2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,Mn元素的化合价由+2价升高到+7价,则MnSO4为还原剂,S元素的化合价由+7降低为+6价,则K2S2O8为氧化剂,据此分析.
解答 解:A、由信息可知,反应物与生成物,则MnSO4+K2S2O8+H2O→KMnO4+K2SO4+8H2SO4,Mn元素的化合价由+2价升高到+7价,S元素的化合价由+7降低为+6价,
由电子守恒及质量守恒定律可知,配平的化学反应为2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,所以有水参加反应,故A正确;
B、因生成KMnO4为紫色,所以反应后溶液呈紫红色,故B错误;
C、2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,Mn元素的化合价由+2价升高到+7价,则MnSO4为还原剂,S元素的化合价由+7降低为+6价,则K2S2O8为氧化剂,故C错误;
D、由2MnSO4+5K2S2O8+8H2O=2KMnO4+4K2SO4+8H2SO4,MnSO4和K2S2O8的化学计量数分别为2、5,故D错误;
故选:A.
点评 本题考查氧化还原反应,明确反应物与生成物并利用化合价的变化来写反应方程式是解答本题的关键,并注意电子守恒的应用来解答此类习题.

练习册系列答案
相关题目
19.下列反应离子方程式正确的是( )
| A. | 向氯化铝溶液中加入过量稀氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 向小苏打溶液中加入醋酸溶液:HCO3-+CH3COOH═CH3COO-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入二氧化碳CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| D. | 向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
20.碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在298k温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
①该温度下,此反应的平衡常数K=$\frac{9}{25}$;
②若反应在398K进行,某时刻测得n(CO)=0.5mol n(H2O)=1.0mol,n(CO2)=1.0mol n(H2)=1.2mol则此时V(正)<V(逆)(填“>”、“<”或“=”).
(4)CaS在一定条件下经原子利用率100%的高温反应生成CaSO4,该反应的化学方程式为CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,对二甲苯的结构产简式为: ,产物的结构简式为
,产物的结构简式为 .
.
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在298k温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②若反应在398K进行,某时刻测得n(CO)=0.5mol n(H2O)=1.0mol,n(CO2)=1.0mol n(H2)=1.2mol则此时V(正)<V(逆)(填“>”、“<”或“=”).
(4)CaS在一定条件下经原子利用率100%的高温反应生成CaSO4,该反应的化学方程式为CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,对二甲苯的结构产简式为:
 ,产物的结构简式为
,产物的结构简式为 .
.
17.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2
CH4(g)+$\frac{1}{2}$O2(g)═CH3OH(l)△H3
H2O(g)═H2O(l)△H4
CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H5
下列关于上述反应焓变的判断不正确的是( )
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H2
CH4(g)+$\frac{1}{2}$O2(g)═CH3OH(l)△H3
H2O(g)═H2O(l)△H4
CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H5
下列关于上述反应焓变的判断不正确的是( )
| A. | △H1>△H2 | B. | △H2=△H1+△H4 | C. | △H3=△H2-△H5 | D. | △H4<0 |
14.现有A、B、C三种化合物,各取40g相混合,完全反应后,得B 18g,C49g,还有D生成.已知D的式量为106.现将22gA和11gB混合反应,能生成D( )
| A. | 1m ol | B. | 0.5mol | C. | 0.275mol | D. | 0.25mol |
1.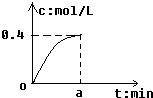 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
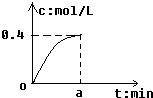 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
18.向100mL0.1mol/L的硫酸铝溶液中滴加0.5mol/L的氢氧化钠溶液,如果得到1.17g沉淀,则消耗的氢氧化钠溶液的体积为( )
| A. | 130ml | B. | 100ml | C. | 90ml | D. | 50ml |