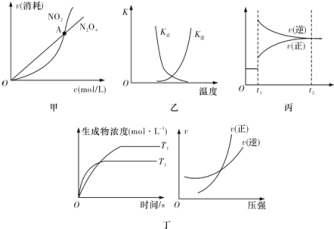
题目内容
【题目】大气中的氮氧化物![]() 、
、![]() 、
、![]() 等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
![]() 汽车发动机工作时会引发反应:
汽车发动机工作时会引发反应:![]() ,
,![]() ,其能量变化示意图如下:
,其能量变化示意图如下:

则NO中氮氧键的键能为______![]() 。
。
![]() 以碱液为电解质可实现如下转化:
以碱液为电解质可实现如下转化:![]()
![]()
![]() ,
,![]() 该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
![]() 将
将![]() 和
和![]() 溶于水可得到相应的酸
溶于水可得到相应的酸![]() 时,两种酸的电离平衡常数如表:
时,两种酸的电离平衡常数如表:
|
| |
|
|
|
|
|
|
①![]() 的水解平衡常数为______。
的水解平衡常数为______。
②![]() 溶液和
溶液和![]() 溶液反应的离子方程式为______。
溶液反应的离子方程式为______。
![]() 汽车尾气处理催化装置中涉及的反应之一为:
汽车尾气处理催化装置中涉及的反应之一为:![]() ,
,![]() 研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验 编号 |
| NO初始浓度 | CO初始浓度 | 催化剂比表面积 |
Ⅰ | 400 |
|
| 82 |
Ⅱ | 400 |
|
| 124 |
Ⅲ | 450 |
|
| 124 |
根据下列坐标图,计算前5s内用![]() 表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势
表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势![]() 标明各条曲线的实验编号
标明各条曲线的实验编号![]() 。______
。______

【答案】632 ![]() ,
,![]() ,高温下情况下满足
,高温下情况下满足![]() ,反应能自发进行
,反应能自发进行 ![]()
![]()
![]()
![]()
【解析】
![]() 反应物的键能总和
反应物的键能总和![]() 生成物的键能总和;
生成物的键能总和;
![]() 根据
根据![]() 来判断反应的自发性,阴极是二氧化碳得到电子发生还原反应;
来判断反应的自发性,阴极是二氧化碳得到电子发生还原反应;
![]() ①
①![]() 的水解平衡常数
的水解平衡常数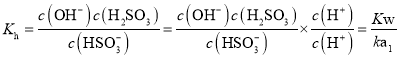 ;
;
②由表可知![]() 的二级电离小于
的二级电离小于![]() 的一级电离,则酸性强弱
的一级电离,则酸性强弱![]() ,据此书写;
,据此书写;
![]() 结合表格中的浓度,利用三段法列出400K时平衡浓度,带入平衡常数表达式计算;根据外界条件对化学反应速率和化学平衡的影响判断。
结合表格中的浓度,利用三段法列出400K时平衡浓度,带入平衡常数表达式计算;根据外界条件对化学反应速率和化学平衡的影响判断。
![]() 设NO中氮氧键的键能为x,
设NO中氮氧键的键能为x,![]() 反应物的键能总和
反应物的键能总和![]() 生成物的键能总和
生成物的键能总和![]() ,解得
,解得![]() ;
;
![]()
![]() ,
,![]() 该反应在一定条件下能自发进行的原因是:反应是一个焓增、熵增的反应,
该反应在一定条件下能自发进行的原因是:反应是一个焓增、熵增的反应,![]() ,
,![]() ,高温下情况下满足
,高温下情况下满足![]() ,反应能自发进行,阴极是二氧化碳得到电子发生还原反应,阴极反应式为:
,反应能自发进行,阴极是二氧化碳得到电子发生还原反应,阴极反应式为:![]() ;
;
![]() ①
①![]() 的水解平衡常数
的水解平衡常数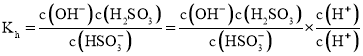
![]() ;
;
②由表可知![]() 的二级电离小于
的二级电离小于![]() 的一级电离,所以酸性强弱
的一级电离,所以酸性强弱![]() ,所以反应的主要离子方程式为
,所以反应的主要离子方程式为![]() ,而不是为
,而不是为![]() ;
;
![]() 设400K达到平衡状态时,则
设400K达到平衡状态时,则

5s内用![]() 表示的反应速率
表示的反应速率![]() ,
,
因Ⅰ、Ⅱ温度相同,初始浓度相等,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,Ⅰ、Ⅱ达平衡时NO的浓度相同,而Ⅲ的温度高,则反应速率最大且平衡逆移,即达到化学平衡时![]() 增大,实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势曲线图为
增大,实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势曲线图为 ;
;

【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2