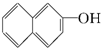
题目内容
13.下列反应既属于氧化还原反应,又是吸热反应的是( )| A. | 生石灰与水作用制熟石灰 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
分析 存在元素的化合价变化的反应为氧化还原反应,常见的吸热反应有:Ba(OH)2•8H2O与NH4Cl反应、大多数的分解反应、C(或氢气)参加的氧化还原反应等,以此来解答.
解答 解:A.为放热反应,且没有元素的化合价变化,不属于氧化还原反应,故A不选;
B.为吸热反应,且C元素的化合价变化,属于氧化还原反应,故B选;
C.为放热反应,甲烷在氧气中的燃烧反应中有元素的化合价变化,属于氧化还原反应,故C不选;
D.为吸热反应,但没有元素的化合价变化,不属于氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应,为高考高频考点,侧重反应类型判断的考查,注意化合价角度及归纳常见的吸热反应分析,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
8.有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D;
③A、C相连后,同时浸入CuSO4溶液中,C极质量增加;
④B、D相连后,同时浸入CuSO4溶液中,Cu2+移向D极被还原.
据此,判断四种金属的活动性顺序是( )
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由C经导线流向D;
③A、C相连后,同时浸入CuSO4溶液中,C极质量增加;
④B、D相连后,同时浸入CuSO4溶液中,Cu2+移向D极被还原.
据此,判断四种金属的活动性顺序是( )
| A. | A>B>D>C | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
18.下列说法正确的是( )
| A. | 邻二溴苯只有一种可以证明苯环结构中不存在单双键交替结构 | |
| B. | 可以用分液漏斗分离苯和硝基苯 | |
| C. | 制取一氯乙烷的最佳途径是通过乙烷与氯气反应获得 | |
| D. | 等物质的量的乙醇和水分别与足量的钠反应,生成的气体体积比为3:1 |
2.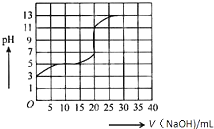 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
 常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )
常温下,用0.50mol/L氢氧化钠溶液滴定某一元弱酸(HA)的溶液中,滴定曲线如图所示,下列叙述不正确的是( )| A. | 该弱酸在滴定前的浓度大于0.001mol/L | |
| B. | 由滴定起点数据可计算该弱酸的Ka(电离平衡常数)为2×10-5 | |
| C. | 滴定过程为求滴定终点,最合适的指示剂是酚酞 | |
| D. | 滴定终点时,c(Na+)>c(A-)>c(OH-)>c(H+) |
 .
.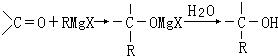
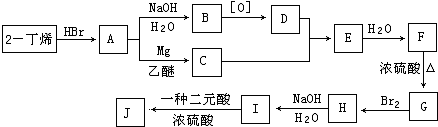
 .
. ,
,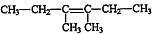 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$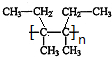 .
.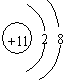 .
. ,所含的化学键类型为离子键、共价键.
,所含的化学键类型为离子键、共价键.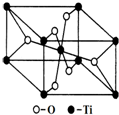 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属.目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4: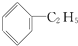 与
与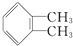
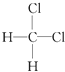 与
与
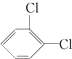 与
与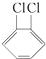
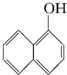 与
与