题目内容
12.X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大.下列说法正确的是( )| A. | M与X形成的化合物对应的水化物一定是强酸 | |
| B. | Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同 | |
| C. | X、Y的简单离子半径:r(X2-)>r(Y+) | |
| D. | X的气态氢化物比M的气态氢化物稳定 |
分析 X、Y、M、N是短周期主族元素,且原子序数依次增大,X原子的最外层电子数是电子层数的3倍,最外层电子数不超过8个,K层不超过2个,所以其电子层数为2,则X是O元素;X、M同主族且都是短周期元素,所以M是S元素;N原子序数大于M且为短周期主族元素,所以N是Cl元素;Y原子在短周期主族元素中原子半径最大,则Y是Na元素,
A.M是S元素、X是O元素,二者形成的化合物对应的水化物亚硫酸是弱酸;
B.Na2O和Na2O2中化学键类型不相同,阴、阳离子的个数比相同;
C.电子层结构相同,核电荷数越大离子半径越小;
D.元素非金属性越强,其气态氢化物的稳定性越强.
解答 解:X、Y、M、N是短周期主族元素,且原子序数依次增大,X原子的最外层电子数是电子层数的3倍,最外层电子数不超过8个,K层不超过2个,所以其电子层数为2,则X是O元素,X、M同主族且都是短周期元素,所以M是S元素;N原子序数大于M且为短周期主族元素,所以N是Cl元素;
Y原子在短周期主族元素中原子半径最大,则Y是Na元素,
A.M是S元素、X是O元素,二者形成的化合物对应的水化物中H2SO4是强酸,但H2SO3是弱酸,故A错误;
B.Na2O中只含离子键、Na2O2中含有共价键和离子键,所以化学键类型不相同,阴、阳离子的个数比都是1:2,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,所以离子半径r:r(O2-)>r(Na+),故C正确;
D.元素非金属性越强,其气态氢化物的稳定性越强,非金属性X(O)>M(S),所以气态氢化物的热稳定性:X>M,故D正确;
故选:CD.
点评 本题考查原子结构和元素周期律的关系,推断元素是解题关键,注意对元素周期律的理解掌握,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
2.将纯锌片和纯铜片用导线连接后放入稀硫酸中发生原电池反应,下列叙述正确的是( )
| A. | 正极有O2逸出 | B. | 负极附近的SO42-浓度逐渐增大 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片表面发生氧化反应 |
3.下列关于甲烷性质的说法中,错误的是( )
| A. | 甲烷是共价化合物 | B. | 甲烷分子具有正四面体结构 | ||
| C. | 甲烷分子具有极性键 | D. | 甲烷分子中H-C-H的键角为90℃ |
20.请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中.
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
试剂:a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液e.新制CaO f.饱和NaCl溶液
分离方法:A.分液 B.过滤 C.洗气 D.蒸馏 F.盐析
| 混合物 | 需加入的试剂 | 分离方法 |
| 苯(苯酚) | ||
| 乙烷(乙烯) | c | C |
| 乙醇(水) | e | |
| 乙酸乙酯(乙酸) |
7.分析下表中四种物质的相关数据,并回答下列问题:
(1)NH3的沸点比PH3高的原因是NH3分子间含有氢键,PH3分子间含有范德华力,氢键比范德华力强.
(2)CH4的分解温度比SiH4高的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3.
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
(2)CH4的分解温度比SiH4高的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3.
17.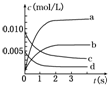 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
(1)上述反应是(填“是”或“不是”)可逆反应,在第 5s时,SO2的转化率为65%;
(2)如图所示,表示SO3变化曲线的是b,用O2表示从0s~2s内该反应的平均速率:v=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是bc.
a.v(SO3)=2v(O2)
b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(4)若上述条件下该反应的△H=-190kJ•mo1-1,若要得到380kJ热量,则加入各物质的物质的量可能是BD.
A.4mo1SO2和2mol O2
B.6mol SO2和6mo1O2
C.4mol SO2和4mo1O2
D.6mo1SO2和4mo1O2.
 在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:
在2L密闭容器内,800℃时反应2SO2(g)+O2(g)=2SO3(g)体系中,n(SO2)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图所示,表示SO3变化曲线的是b,用O2表示从0s~2s内该反应的平均速率:v=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是bc.
a.v(SO3)=2v(O2)
b.混合气体中SO2的体积分数保持不变
c.v逆(SO2)=2v正(O2)
d.容器内密度保持不变
(4)若上述条件下该反应的△H=-190kJ•mo1-1,若要得到380kJ热量,则加入各物质的物质的量可能是BD.
A.4mo1SO2和2mol O2
B.6mol SO2和6mo1O2
C.4mol SO2和4mo1O2
D.6mo1SO2和4mo1O2.
4.下列醇既能发生消去反应,又能被氧化为醛的是( )
| A. | CH3OH | B. |  | C. |  | D. |  |
1. 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)$\frac{\underline{\;高温、高压\;}}{催化剂}$2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间t变化的关系如图所示.下列叙述中,正确的是( )| A. | 点c处正反应速率和逆反应速率相等 | |
| B. | 点a处的正反应速率比点b处的大 | |
| C. | 点d(t1时)和点e(t2时)处n(N2)不同 | |
| D. | 在t2时,正反应速率大于逆反应 |
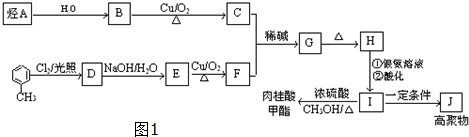
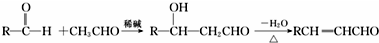
 ,J的结构简式为
,J的结构简式为 .
.
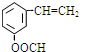 、
、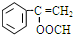 .
.