题目内容
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②H2O ③HCl气体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥B.①②C.②③⑤D.②④⑤⑥
【答案】A
【解析】
①加入NaOH固体后将会不可逆地消耗氢离子,减缓反应速度同时也减少了氢气生成量,故不选①;
②加入水可以降低氢离子浓度进而减缓反应速率,故选②;
③通入HCl气体后,溶液中氢离子浓度增大,会加快化学反应速率并导致氢气总量增加,故不选③;
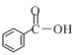
④加入醋酸钠固体后,![]() ,会暂时降低
,会暂时降低![]() ,随着反应进行
,随着反应进行![]() 被消耗,该平衡会逐渐正向移动直到释放出所有的
被消耗,该平衡会逐渐正向移动直到释放出所有的![]() ,故氢气生成量不影响,故选④;
,故氢气生成量不影响,故选④;
⑤加入![]() 固体后电离产生
固体后电离产生![]() ,在酸性环境下具有强氧化性,将会消耗
,在酸性环境下具有强氧化性,将会消耗![]() 生成NO和水而非氢气,故不选⑤;
生成NO和水而非氢气,故不选⑤;
⑥加入KCl溶液相当于起到稀释作用,故选⑥。
答案为A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
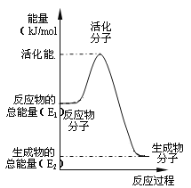
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则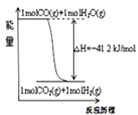 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.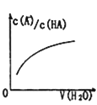 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,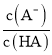 的变化情况
的变化情况