题目内容
已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图所示。

反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)________c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。
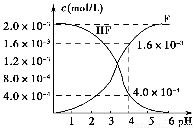
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:____________________________________________。
(1)Ka(HSCN)>Ka(CH3COOH),溶液中c(H+):HSCN>CH3COOH,
c(H+)大反应速率快 >
(2) =
= =4×10-4
=4×10-4
(3)有 溶液中离子积Qc=c(Ca2+)·c2(F-)=5.12×10-10>Ksp(CaF2)=1.5×10-10
【解析】 (1)由Ka(CH3COOH)、Ka(HSCN)的数据知,相同物质的量浓度溶液HSCN的酸性比CH3COOH强,HSCN溶液中c(H+)大,所以反应开始时HSCN溶液与NaHCO3溶液反应的速率快。反应结束后所得两溶液分别为CH3COONa溶液和NaSCN溶液,由于HSCN的酸性比CH3COOH强,则SCN-的水解程度比CH3COO-弱,所以c(SCN-)>c(CH3COO-)。(2)当pH=4时,由图像可知,c(F-)=1.6×10-3 mol·L-1,c(HF)=4.0×10-4mol·L-1,c(H+)=1×10-4mol·L-1,代入Ka(HF)= 即可。(3)当pH=4时,溶液中的c(F-)=1.6×10-3 mol·L-1,溶液中c(Ca2+)=2.0×10-4 mol·L-1,溶液中离子积Qc=c(Ca2+)·c2(F-)=5.12×10-10>Ksp(CaF2)=1.5×10-10,故有沉淀产生。
即可。(3)当pH=4时,溶液中的c(F-)=1.6×10-3 mol·L-1,溶液中c(Ca2+)=2.0×10-4 mol·L-1,溶液中离子积Qc=c(Ca2+)·c2(F-)=5.12×10-10>Ksp(CaF2)=1.5×10-10,故有沉淀产生。

(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
t/s c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/(mol·L-1) | 0.100 | a | 0.5b | 0.4b |
|
|
c(NO2)/(mol·L-1) | 0 | 0.060 | b | c1 | c2 | c3 |
请回答下列问题:
①表中a=________,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为________________________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l)??H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:____________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是_______________________________。









