题目内容
6.表是周期表中的一部分,根据A-I的位置,用元素符号或化学式回答下列问题: | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | F | G | I | |||
| 3 | B | C | H |
(2)A-I元素中,非金属性最强的元素与金属性最强的元素形成的物质是Na,该物质的熔点比干冰的熔点高(填“低”或“高”).
(3)比较D、E最高价氧化物的水化物酸性强弱HNO3>H2CO3.
(4)G、H的氢化物沸点较高的是HF,理由是HF分子间含氢键.
(5)A、E、H组成的常见物质的电子式为
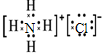 .
.(6)用电子式表示E的氢化物的形成过程3H•+
 →
→ .
.
分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为O,G为F,H为Cl,I为Ne,
(1)稀有气体的性质稳定;
(2)短周期中F的非金属性最强,Na的金属性最强,一般熔点为离子晶体>分子晶体;
(3)非金属性越强,最高价氧化物的水化物酸性越强;
(4)HF中含氢键,沸点高;
(5)A、E、H组成的常见物质为氯化铵;
(6)E的氢化物为氨气,为共价化合物.
解答 解:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为O,G为F,H为Cl,I为Ne,
(1)以上元素中,只有Ne的最外层电子为8,为稳定结构,则化学性质不活泼,故答案为:Ne;
(2)F的非金属性最强,Na的金属性最强,二者形成离子化合物NaF,该物质的熔点比干冰的熔点高,故答案为:NaF;高;
(3)非金属性越强,最高价氧化物的水化物酸性越强,则酸性为HNO3>H2CO3,故答案为:HNO3>H2CO3;
(4)G、H的氢化物沸点较高的是HF,理由是HF分子间含氢键,故答案为:HF;HF分子间含氢键;
(5)A、E、H组成的常见物质为氯化铵,其电子式为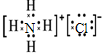 ,故答案为:
,故答案为: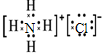 ;
;
(6)E的氢化物为氨气,为共价化合物,用电子式表示形成过程为3H•+ →
→ ,故答案为:3H•+
,故答案为:3H•+ →
→ .
.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
相关题目
14.某工厂的电镀污泥中含有铜、铁等金属化合物.为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
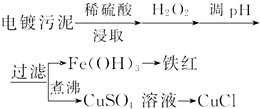
(1)酸浸后加入H2O2的目的是将Fe2+氧化成Fe3+,便于调整pH值与Cu2+分离.调pH步骤中加入的试剂最好是CuO、或Cu(OH)2、或CuCO3(填化学式).实验室进行过滤操作所用到的玻璃仪器有漏斗、烧杯、、玻璃棒.
(2)煮沸CuSO4溶液的原因是除净溶液中的H2O2,避免影响下一步CuCl的生成.
向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数表达式为K=$\frac{c{\;}^{3}(H{\;}^{+})}{c(Fe{\;}^{3+})}$.
(4)称取所制备的CuCl样品0.250 0g置于一定量的0.5mol•L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.100 0mol•L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL.有关的化学反应为Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+.计算该CuCl样品的质量分数99.50%.

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(2)煮沸CuSO4溶液的原因是除净溶液中的H2O2,避免影响下一步CuCl的生成.
向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数表达式为K=$\frac{c{\;}^{3}(H{\;}^{+})}{c(Fe{\;}^{3+})}$.
(4)称取所制备的CuCl样品0.250 0g置于一定量的0.5mol•L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.100 0mol•L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL.有关的化学反应为Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+.计算该CuCl样品的质量分数99.50%.
1.下列关于弱电解质的电离平衡常数的叙述中,正确的是( )
| A. | 因为电离过程是吸热过程,所以温度越高,同一弱电解质的电离平衡常数越大,电离度越小 | |
| B. | 弱电解质的电离平衡常数是由各微粒的平衡浓度表达的,所以弱电解质的电离平衡常数只与浓度有关 | |
| C. | 对于不同的弱酸,电离平衡常数越大,酸性一定越强,可以通过电离平衡常数的大小判断弱酸的相对强弱 | |
| D. | 弱电解质的电离平衡常数是衡量弱电解质电离程度大小的一种方法 |
5.新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同:温度低于570℃时生成FeO,高于570℃时生成Fe3O4.甲同学用图1所示装置进行纳米级铁粉与水蒸气反应的实验:
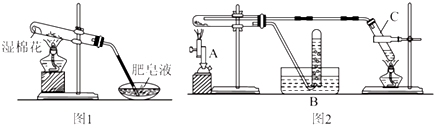
(1)该装置中纳米级铁粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;高温\;}}{\;}$FeO+H2.
乙同学用图2所示装置进行纳米级铁粉与水蒸气的反应并验证产物:
(2)装置C的作用是制取水蒸气.
(3)酒精灯和酒精喷灯都是实验室常用的加热仪器,在该实验中应先点燃酒精灯.
(4)不能撤除收集气体产物装置B的原因是氢气遇明火可能发生爆炸.
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
乙同学认为该条件下反应的固体产物为FeO.丙同学认为该结论不正确,他的理由是Fe+2H+═2Fe2++H2↑,2Fe3++Fe═3Fe2+(用离子方程式表示).
(6)丁同学称取5.60 g铁粉,用图2所示装置反应一段时候后,停止加热.将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3 0.08 mol.则丁同学所做实验的固体产物为Fe3O4.

(1)该装置中纳米级铁粉与水蒸气反应的化学方程式是Fe+H2O(g)$\frac{\underline{\;高温\;}}{\;}$FeO+H2.
乙同学用图2所示装置进行纳米级铁粉与水蒸气的反应并验证产物:
(2)装置C的作用是制取水蒸气.
(3)酒精灯和酒精喷灯都是实验室常用的加热仪器,在该实验中应先点燃酒精灯.
(4)不能撤除收集气体产物装置B的原因是氢气遇明火可能发生爆炸.
(5)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后的黑色粉末X(假定成分分布均匀)取出少量,放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验Ⅰ中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
(6)丁同学称取5.60 g铁粉,用图2所示装置反应一段时候后,停止加热.将试管内的固体物质在干燥器中冷却后,称得质量为6.88 g.然后将冷却后的固体物质与足量FeCl3溶液充分反应,消耗FeCl3 0.08 mol.则丁同学所做实验的固体产物为Fe3O4.
2.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率分别如下,其中反应速率最大的是( )
| A. | vA=0.15mol•L-1•min-1 | B. | vB=0.6mol•L-1•min-1 | ||
| C. | vC=0.35mol•L-1•min-1 | D. | vD=0.02mol•L-1•s-1 |
3.下列酸中,通式与另三种酸不同的是( )
| A. | 甲酸 | B. | 硬脂酸 | C. | 油酸 | D. | 软脂酸 |