题目内容
14.某离子化合物的晶胞如图所示.阳离子位于晶胞的中心,阴离子位于晶胞的8个顶点上,则该离子化合物中阴、阳离子个数比为( )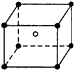
| A. | 1:8 | B. | 1:4 | C. | 1:2 | D. | 1:1 |
分析 利用均摊法计算晶胞中阴阳离子个数,该晶胞中阳离子个数为1,阴离子个数=8×$\frac{1}{8}$=1,据此计算晶胞中阴阳离子个数之比.
解答 解:利用均摊法计算晶胞中阴阳离子个数,该晶胞中阳离子个数为1,阴离子个数=8×$\frac{1}{8}$=1,所以该晶胞中阳离子、阴离子个数之比=1:1,故选D.
点评 本题考查晶胞计算,侧重考查分析计算能力,明确每个顶点上离子被几个晶胞共用是解本题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.某物质加聚生成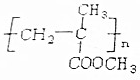 ,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )
,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )
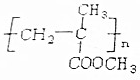 ,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )
,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )| A. | 丁酸 | B. | CH2=CHCH2COOH | C. | 甲酸丙酯 | D. | 丙烯酸甲酯 |
9.下列有关物质的量浓度溶液配制的说法中正确的是( )
| A. | 将58.5gNaCl溶于1L水中所得溶液的物质的量浓度为1mol•L-1 | |
| B. | 将5.85molNaCl投入100mL容量瓶中加水至刻度线,充分振荡后浓度为1mol•L-1 | |
| C. | 引流时,玻璃棒可以靠在容量瓶的瓶口上 | |
| D. | 需要480mL0.1mol•L-1的NaCl溶液,配制时应选用500mL容量瓶 |
19.图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )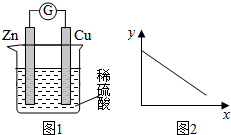

| A. | 铜棒的质量 | B. | c(Zn2+) | C. | c(H+) | D. | c(SO42-) |
6.称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1molNaOH的溶液,完全反应,生成NH3 1792ml(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1.87:1 | D. | 3.65:1 |
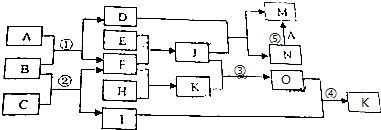
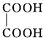
 +NaBr+H2O;
+NaBr+H2O;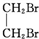 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$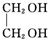 +2NaBr;
+2NaBr;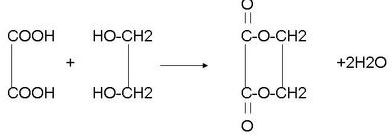 .
.