题目内容
18.有A、B、C、D、E五种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称及元素符号:B、氧(O);C、钠(Na);D、铝(Al);E、氯(Cl).
(2)C与B形成的两种离子化合物的化学式为:Na2O、Na2O2.
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键.
分析 由A单质是密度最小的物质,可知A为H;B的阴离子带两个单位负电荷,单质是空气的主要成分之一,则B为O;C的阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物,则C为Na;D的氢氧化物和氧化物都有两性,与C同周期,则D为Al;E与C同周期,原子半径在该周期最小,则E为Cl,以此来解答.
解答 解:由A单质是密度最小的物质,可知A为H;B的阴离子带两个单位负电荷,单质是空气的主要成分之一,则B为O;C的阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物,则C为Na;D的氢氧化物和氧化物都有两性,与C同周期,则D为Al;E与C同周期,原子半径在该周期最小,则E为Cl,
(1)由上述分析可知,B、C、D、E分别为氧(O)、钠(Na)、铝(Al)、氯(Cl),
故答案为:氧(O);钠(Na);铝(Al);氯(Cl);
(2)C与B形成的两种离子化合物的化学式为Na2O、Na2O2,故答案为:Na2O、Na2O2;
(3)实验测得DE3在熔融状态下不导电,由分子构成,不含离子键,则DE3中含有的化学键类型为共价键,故答案为:共价键.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素化合物性质推断元素为解答的关键,侧重分析与应用能力的考查,注意离子化合物、共价键等判断,题目难度不大.

练习册系列答案
相关题目
9.有下列八种物质:①氯化钙、②金刚石、③硫、④氢氧化钠、⑤二氧化硅、⑥干冰,回答有关这八种物质的问题.(用编号回答)
(1)将这八种物质按不同晶体类型分成四组,并填写下表:
(2)属于共价化合物的是⑤⑥;含有共价键的离子化合物是④;
(3)其中硬度最大的物质是②;熔点最低的物质是⑥.
(1)将这八种物质按不同晶体类型分成四组,并填写下表:
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 |
| 各组中物质的编号 | ①④ | ②⑤ | ③⑥ |
(3)其中硬度最大的物质是②;熔点最低的物质是⑥.
3.氯乙烯是合成高聚物聚氯乙烯的单体,工业制取氯乙烯需要以下反应:①乙炔与氯化氢反应生成氯乙烯 ②高温煅烧石灰石 ③电解饱和食盐水 ④制取乙炔 ⑤制取乙烯 ⑥合成氯化氢 ⑦制取水煤气 ⑧制取盐酸 ⑨制取电石,则制取氯乙烯的正确操作是( )
| A. | ③→⑧→①←④→⑨ | B. | ⑦→③→⑥→①←④→⑨→② | C. | ②→⑨→④→①←⑥←③ | D. | ②→④→⑤→①←⑥←③ |
7.某温度下.在一容积不变的密闭容器中充入2molSO2和1molO2,一段时间后反应达到平衡状态,测得平衡时的压强为反应前的0.8倍.则SO2的转化率为( )
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
8.下列物质中,从化学键的角度看,有一种与其他三种明显不同,这种物质是( )
| A. | NaOH | B. | N2 | C. | SO2 | D. | H2O |
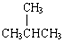 ;④CH4与C3H8;⑤CH3CH2CH2CH3与
;④CH4与C3H8;⑤CH3CH2CH2CH3与 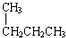 .请回答下列问题:
.请回答下列问题: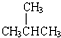 的名称是2-甲基丙烷.
的名称是2-甲基丙烷.

 .
. .
. 与过量的
与过量的 也可以发生Reformatsky反应,试写出该生成物的结构简式
也可以发生Reformatsky反应,试写出该生成物的结构简式 .
.