题目内容
15.下列离子方程式不正确的是( )| A. | FeCl3溶液腐蚀铜印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 硫酸铝溶液中加入过量NaOH溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 浓NaOH溶液处理少量二氧化硫:SO2+OH-═HSO3- | |
| D. | 盛放NaOH溶液的试剂瓶不能使用玻璃塞:SiO2+2OH-═SiO32-+H2O |
分析 A.反应生成氯化铜、氯化亚铁,遵循电子、电荷守恒;
B.反应生成偏铝酸钠和水;
C.反应生成亚硫酸钠和水;
D.反应生成的硅酸钠溶液具有粘合性.
解答 解:A.FeCl3溶液腐蚀铜印刷电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,故A正确;
B.硫酸铝溶液中加入过量NaOH溶液的离子反应为Al3++4OH-═AlO2-+2H2O,故B正确;
C.浓NaOH溶液处理少量二氧化硫的离子反应为SO2+2OH-═SO32-+H2O,故C错误;
D.盛放NaOH溶液的试剂瓶不能使用玻璃塞的离子反应为SiO2+2OH-═SiO32-+H2O,故D正确;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
5.根据图的转化关系判断,下列说法正确的是(反应条件已略去)( )
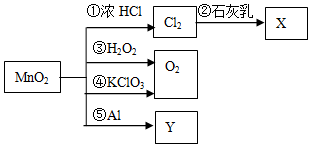

| A. | 反应①中氧化剂与还原剂的物质的量之比为1:4 | |
| B. | 利用反应②可制漂白粉,反应⑤可制金属Mn | |
| C. | 生成等质量的O2,反应③和④转移的电子数相等 | |
| D. | 在反应①③④⑤中,MnO2均作氧化剂 |
6.下列各组离子在溶液中能够大量共存的是( )
| A. | NH4+、Ca2+、OH-、HCO3- | B. | NH4+、Br-、Na+、SO42- | ||
| C. | Ag+、H+、SO32-、ClO- | D. | H+、Cl-、Fe2+、CO32- |
3.柔性电子产品因具有独特的柔性、延展性等优点在信息、医疗、能源等领域具有广泛应用前景.下图为中科院张新波课题组受中国传统书法艺术启发,直接将用毛笔书写后的纸张和锂箔作为电极材料组装成的锂空气电池.下列说法不正确的是( )


| A. | 纸张电极是该电池的正极 | |
| B. | 锂箔电极发生的电极反应:Li-e-═Li+ | |
| C. | 电池工作时,电子从锂箔电极经导线流向纸张电极,再从纸张电极经电解质溶液流向锂箔电极 | |
| D. | 该电池具有轻型、柔性且可折叠的特点,有望应用于柔性电子器件 |
10.下列有关Na2CO3和NaHCO3比较中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,0.1mol•L-1盐溶液的pH值:Na2CO3>NaHCO3 | |
| C. | 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应放出气体的量:Na2CO3<NaHCO3 | |
| D. | 相同温度下,0.1mol•L-1盐溶液分别与0.1mol•L-1HCl反应的剧烈程度:Na2CO3>NaHCO3 |
20.下列能使湿润的淀粉碘化钾变蓝的是( )
| A. | SO2 | B. | HCl | C. | KBr | D. | Cl2 |
7.下列仪器名称为“蒸馏烧瓶”的是( )
| A. |  | B. |  | C. |  | D. |  |
4.下列离子方程式中正确的是( )
| A. | 氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | 向NaAlO2溶液中通入过量二氧化碳:AlO2-+H2O+CO2═Al(OH)3↓+HCO3- | |
| C. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| D. | NH4Cl溶液和稀NaOH溶液反应:NH4++OH-═NH3•H2O |
13.下列有关实验的说法正确的是( )
| A. | 除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 | |
| C. | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色说明FeCl2具有漂白性 | |
| D. | 某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为Cl2有强氧化性 |