题目内容
1.化学与生活密切相关,下列有关说法错误的是( )| A. | 用陈化的粮食酿造的酒精可以饮用 | |
| B. | 地沟油不能食用是因为反复加热会产生稠环芳香烃等有害物质 | |
| C. | 铜盐有毒,是因为可使蛋白质变性,但可以用于消毒、杀菌 | |
| D. | 用次氯酸盐,漂白、杀菌、消毒 |
分析 A.用陈化的粮食酿造的酒精含有黄曲霉素;
B.地沟油经反复加热可生成稠环芳香烃;
C.铜盐为重金属盐,可使蛋白质变性,可用于杀菌消毒;
D.次氯酸盐具有强氧化性,可生成具有漂白性的次氯酸.
解答 解:A.用陈化的粮食酿造的酒精含有黄曲霉素,可致癌,对人体有害,故A错误;
B.地沟油经反复加热可生成稠环芳香烃,可致癌,不能用于食用油,故B正确;
C.铜盐为重金属盐,可使蛋白质变性,可用于杀菌消毒,可用于除去害虫,故C正确;
D.次氯酸盐具有强氧化性,可用于杀菌消毒,可生成次氯酸,具有漂白性,故D正确.
故选A.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,为高频考点,有利于培养学生良好的科学素养,明确物质组成、性质、用途关系是解本题关键,会根据物质性质解释其用途,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
15.某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下.
向硝酸酸化的0.05mol•L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有Fe2+.
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是Fe+2Fe3+=3Fe2+(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据白色沉淀现象,判断溶液中存在Ag+,可产生Fe3+.
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是FeCl2/FeCl3,操作及现象是按图连接好装置,电流表指针发生偏转.
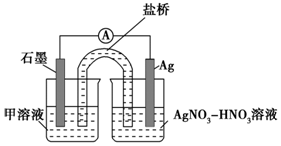
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN-,红色变浅.
向硝酸酸化的0.05mol•L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,加入足量加入足量稀盐酸(或稀硫酸)酸化,固体未完全溶解(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有Fe2+.
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是Fe+2Fe3+=3Fe2+(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
| ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较3 0min时变浅 |
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据白色沉淀现象,判断溶液中存在Ag+,可产生Fe3+.
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的NaNO3溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是FeCl2/FeCl3,操作及现象是按图连接好装置,电流表指针发生偏转.

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:i→ii Ag++Fe2+=Ag+Fe3+,反应生成Fe3+的使Fe3+增加,红色变深,ii→iii 空气中氧气氧化SCN-,红色变浅.
7.萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

| A. | a和b都属于芳香族化合物 | |
| B. | a和c分子中所有碳原子均处于同一平面上 | |
| C. | a、b和c均能使酸性KMnO4溶液褪色 | |
| D. | b和c均能与新制的Cu(OH)2反应生成红色沉淀 |
9.燃烧0.2mol某有机物,得到0.4mol CO2和 0.6mol H2O,由此可得出的结论是( )
| A. | 该有机物中含有2个碳原子和6个氢原子 | |
| B. | 该有机物中碳和氢的原子个数比为3:1 | |
| C. | 该有机物中含有2个CO2和3个H2O | |
| D. | 该有机物的1个分子里含2个碳原子和6个氢原子,还可能含有氧原子 |
16.安溪“铁观音”茶属于半发酵茶类,独具“观音韵”,有“七泡有余香之誉”.具有抗衰老、抗动脉硬化、防治糖尿病、减肥健美、防治龋齿、清热降火,敌烟醒酒等功效.为方便饮用,可通过以下方法制取罐装饮料茶:关于上述过程涉及的实验方法、实验操作和物质作用中说法不正确的是( )
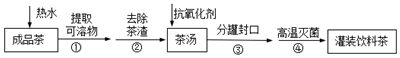

| A. | 步骤②是过滤 | |
| B. | 步骤③是分液,主要仪器是分液漏斗 | |
| C. | 步骤④高温灭菌的原理是使蛋白质细菌变性 | |
| D. | 茶多酚容易被氧化,抗氧化剂可选用维生素C |
6.短周期主族元素A、B、C、D、E的原子序数依次增大,考古时利用A元素的某种同位素可以测定一些文物的年代,A原子的最外层比B原子的最外层少2个电子,A、B、C三种元素能组成离子化合物C2AB3,B、D同主族.下列说法正确的是( )
| A. | 含氧酸的酸性由强到弱的顺序:E、D、A | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:B、D、E | |
| C. | B、C、E形成的共价化合物CEB可以用来杀菌消毒 | |
| D. | 简单离子半径由大到小的顺序:D、E、B、C |
13.化学与社会、生活密切相关.下列说法正确的是( )
| A. | 在食品袋中放入盛有硅胶的透气小袋可防止食品因氧化而变质 | |
| B. | 燃烧煤、天然气、石油等排放的大量CO2是导致雾霾产生的原因 | |
| C. | 漂白精可用作消毒剂是由于Ca(ClO)2可转化为HClO | |
| D. | 小苏打能做糕点的膨松剂是由于NaHCO3能与碱反应 |
10.由原子序数依次递增的短周期元素W、X、Y、Z组成的化合物A在一定条件下完全分解,生成甲、乙、丙、丁四种气体,甲、乙分别能使无水硫酸铜、湿润的红色石蕊试纸变蓝,丙能用品红试液检验,丁是大气中与人类生命活动关系最密切的一种气体.下列说法正确的是( )
| A. | 原子半径:W<X<Y<Z | |
| B. | 1mol简单氢化物分别溶于等体积的水中形成体系的pH:Z>Y>X | |
| C. | W与X或Y都能形成既含极性键,又含非极性键的化合物 | |
| D. | 在化合物A的分解反应中丙为氧化产物,丁为还原产物 |
