题目内容
【题目】(化学---选修3:物质结构与性质)
(1)![]() 中
中![]() 原子的杂化轨道类型为____________,
原子的杂化轨道类型为____________,![]() 分子空间构型为________________。
分子空间构型为________________。
(2)已知:硼酸的电离方程式为![]() ,试依据上述反应写出
,试依据上述反应写出![]() 的结构式____________________。
的结构式____________________。
(3)钛铁矿经过![]() 等多种物质处理后会生成
等多种物质处理后会生成![]() 等中间产物。
等中间产物。
①![]() 晶体中存在_________________(填字母代号)。
晶体中存在_________________(填字母代号)。
A. 离子键 B. ![]() 键 C.
键 C. ![]() 键 D.氢键
键 D.氢键
②![]() 为粘稠状、难挥发性的强酸,而
为粘稠状、难挥发性的强酸,而![]() 是易挥发性的强酸,其原因是____________________。
是易挥发性的强酸,其原因是____________________。
(4)![]() 是离子晶体,其晶格能可通过下图的
是离子晶体,其晶格能可通过下图的![]() 循环计算得到。
循环计算得到。
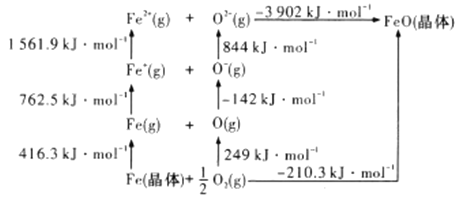
可知,![]() 原子的第一电子亲和能为___________
原子的第一电子亲和能为___________![]() ,
,![]() 晶格能为______________
晶格能为______________![]() 。
。
(5)![]() 可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。
可用于制造高温发热元件,其在高温时具有立方晶型,晶胞如图所示。

已知晶胞参数为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则
,则![]() 原子与
原子与![]() 原子之间的最短距离为_______
原子之间的最短距离为_______![]() ;
;![]() 的密度为_______________________
的密度为_______________________![]() (列式表示)。
(列式表示)。
【答案】![]() 平面正三角形
平面正三角形 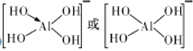
![]()
![]() 分子之间容易形成氢键,而
分子之间容易形成氢键,而![]() 易形成分子内氢键,造成分子间作用力减弱,易挥发 142 3902
易形成分子内氢键,造成分子间作用力减弱,易挥发 142 3902 ![]() 或
或![]()
![]()
【解析】
综合应用杂化、分子空间构型、化学键、第一电子亲合能、晶格能、氢键、晶胞等概念或理论分析解答问题。
(1)![]() 分子中,中心原子
分子中,中心原子![]() 的价层电子对数为(3+3)/2=3,即B原子形成3个
的价层电子对数为(3+3)/2=3,即B原子形成3个![]() 键,没有孤对电子,
键,没有孤对电子,![]() 原子的杂化轨道类型为
原子的杂化轨道类型为![]() 杂化,
杂化,![]() 分子空间构型为平面三角形。
分子空间构型为平面三角形。
(2)![]() 和
和![]() 位于同一主族,形成化合物的结构具有相似性,
位于同一主族,形成化合物的结构具有相似性,![]() 的结构式为
的结构式为
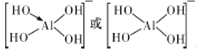 。
。
(3)①![]() 晶体中,TiO2+、SO42-之间有离子键,阴、阳离子内都有
晶体中,TiO2+、SO42-之间有离子键,阴、阳离子内都有![]() 键,SO42-内硫原子的3d空轨道接受氧原子的孤电子对形成d-p
键,SO42-内硫原子的3d空轨道接受氧原子的孤电子对形成d-p ![]() 配键(超中学要求),故选ABC。
配键(超中学要求),故选ABC。
②![]() 形成分子间氢键,增强了分子间相互作用,使其难挥发。而
形成分子间氢键,增强了分子间相互作用,使其难挥发。而![]() 形成分子内氢键,减弱了分子间相互作用,故其易挥发。
形成分子内氢键,减弱了分子间相互作用,故其易挥发。
(4)第一电子亲合能是指1mol气态原子获得电子形成负一价阴离子所放出的能量,图中![]() 原子的第一电子亲和能为142
原子的第一电子亲和能为142![]() ;离子晶体的晶格能是指气态阴阳离子形成1 mol离子晶体所放出的能量,图中
;离子晶体的晶格能是指气态阴阳离子形成1 mol离子晶体所放出的能量,图中![]() 晶格能为3092
晶格能为3092![]() 。
。
(5)![]() 中Zr、O元素的化合价分别是+4、-2价,晶胞中Zr的配位数为8,则O的配位数为4,即氧原子位于最邻近的4个锆原子围成的正四面体中心。若晶胞体心有一个锆原子,则晶胞体对角线为
中Zr、O元素的化合价分别是+4、-2价,晶胞中Zr的配位数为8,则O的配位数为4,即氧原子位于最邻近的4个锆原子围成的正四面体中心。若晶胞体心有一个锆原子,则晶胞体对角线为![]() 、
、![]() 原子之间最短距离的4倍。故
原子之间最短距离的4倍。故![]() 原子与
原子与![]() 原子之间的最短距离为
原子之间的最短距离为![]() nm=
nm=![]() nm。
nm。
1个晶胞有4个“![]() ”,质量m=(4/NA)×123g,体积V=(a×10-7cm)3,故密度ρ=m/V=
”,质量m=(4/NA)×123g,体积V=(a×10-7cm)3,故密度ρ=m/V=![]()
![]() 。
。