题目内容
 合成氨对农业生产及国防建设均具有重要意义.
合成氨对农业生产及国防建设均具有重要意义.N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol
(1)在恒温恒容密闭容器中进行的合成氨反应,当反应达到平衡时
a.混合气体的压强不再发生变化
b.反应物不再转化为生成物
c.v正(N2)=3v逆(H2)
d.2v(N2)=v(NH3)
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如图所示.请回答下列问题:
①表示N2 的浓度变化的曲线是
②前25min内,用H2 的浓度变化表示的化学反应平均速率是
③在25min末反应刚好达到平衡,则该温度下反应2NH3(g)?N2(g)+3H2(g)的平衡常数K=
(3)在第25min末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35min末再次达到平衡.平衡移动过程中H2浓度变化了1.5mol/L,请你在图中画出第25min~40min NH3浓度变化曲线.
(4)在一定温度下,将1mol N2和2mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得N2的转化率α1,NH3体积分数为φ1.此时向该容器中再通入一定量的H2,一段时间后再次达到平衡,测得N2的转化率α2,NH3体积分数为φ2,则α2
a.大于 b.小于 c.等于 d.以上均有可能.
考点:物质的量或浓度随时间的变化曲线,化学平衡建立的过程,化学平衡状态的判断
专题:化学平衡专题
分析:(1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不再发生变化,由此衍生的一些物理性不变,以此解答该题;
(2)①、根据反应物的变化趋势判断反应物和生成物再根据计量数之比确定具体物质;
②、由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,根据v=
计算v(H2);
③、由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,代入平衡常数表达式计算;
(3)升高温度,平衡向吸热反应方向移动,也就量向平衡向氨气浓度减小的方向移动,平衡移动过程中H2浓度变化了1.5mol/L,则氨气浓度变化1mol/L,由此作出图象;
(4)增加一种反应物的量,另一种物质的转化率增加,本身的转化率降低;平衡正向移动,NH3体积分数受通入氢气的量不同,可能变大,可能变小,也有可能不变.
(2)①、根据反应物的变化趋势判断反应物和生成物再根据计量数之比确定具体物质;
②、由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,根据v=
| △c |
| △t |
③、由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,代入平衡常数表达式计算;
(3)升高温度,平衡向吸热反应方向移动,也就量向平衡向氨气浓度减小的方向移动,平衡移动过程中H2浓度变化了1.5mol/L,则氨气浓度变化1mol/L,由此作出图象;
(4)增加一种反应物的量,另一种物质的转化率增加,本身的转化率降低;平衡正向移动,NH3体积分数受通入氢气的量不同,可能变大,可能变小,也有可能不变.
解答:
解:(1)a.混合气体的压强不再发生变化,气体的总的物质的量进行,压强降低,故混合气体的压强不再发生变化,说明到达平衡,故a正确;
b.反应物不再转化为生成物,化学平衡是动态平衡,故b错误;
c.v正(N2)=3v逆(H2),速率之比不等于计量数之比,故c错误;
d.2v(N2)=v(NH3),未体现正逆,故d错误;
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比,不能说明浓度不变,故e错误;
故答案为:a;
(2)①、由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,故答案为:C;
②、所以v(H2)=
=0.12 mol?L-1?min-1,
故答案为:0.12;
③、由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,
平衡常数k′=
=0.15,所以反应2NH3(g)?N2(g)+3H2(g)的平衡常数K=
=
=6.75,
故答案为:6.75;
(3)升高温度,平衡向吸热反应方向移动,也就量向平衡向氨气浓度减小的方向移动,平衡移动过程中H2浓度变化了1.5mol/L,则氨气浓度变化1mol/L,由此作出图象为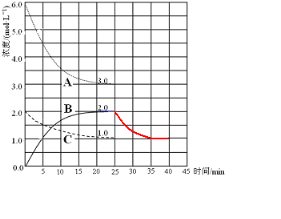 ,故答案为:
,故答案为: ;
;
(4)增加一种反应物的量,另一种物质的转化率增加,本身的转化率降低;平衡正向移动,NH3体积分数受通入氢气的量不同,可能变大,可能变小,也有可能不变,故答案为:a,d.
b.反应物不再转化为生成物,化学平衡是动态平衡,故b错误;
c.v正(N2)=3v逆(H2),速率之比不等于计量数之比,故c错误;
d.2v(N2)=v(NH3),未体现正逆,故d错误;
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比,不能说明浓度不变,故e错误;
故答案为:a;
(2)①、由图可知,平衡时△c(A)=3mol/L、△c(B)=2mol/L、△c(C)=1mol/L,故△c(A):△c(B):△c(C)=3:2:1,故A代表氢气、B代表氨气、C代表氮气,故答案为:C;
②、所以v(H2)=
| 3mol/L |
| 25min |
故答案为:0.12;
③、由可知平衡时各组分的平衡浓度,c(H2)=3mol/L、c(N2)=1mol/L、c(NH3)=2mol/L,
平衡常数k′=
| 22 |
| 1×33 |
| 1 |
| K′ |
| 1 |
| 0.15 |
故答案为:6.75;
(3)升高温度,平衡向吸热反应方向移动,也就量向平衡向氨气浓度减小的方向移动,平衡移动过程中H2浓度变化了1.5mol/L,则氨气浓度变化1mol/L,由此作出图象为
 ,故答案为:
,故答案为: ;
;(4)增加一种反应物的量,另一种物质的转化率增加,本身的转化率降低;平衡正向移动,NH3体积分数受通入氢气的量不同,可能变大,可能变小,也有可能不变,故答案为:a,d.
点评:本题考查较综合,涉及知识点较多,注意通过图象分析化学反应速率、化学平衡及计算问题,需要学生较强的观察能力及思维能力,难度较大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列元素中,非金属性最强的是( )
| A、P | B、S | C、Cl | D、Ar |
下列叙述正确的是( )
| A、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
| B、铜片加入氯化铁溶液中发生反应:3Cu+2Fe3+=3Cu2++2Fe |
| C、FeCl2、Fe(OH)3、Cu2S均可通过化合反应制得 |
| D、在pH=1溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |

 快乐是什么?专家通过实验发现:在大脑的相应部位--“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图:
快乐是什么?专家通过实验发现:在大脑的相应部位--“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图:
 硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题:
硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题: