题目内容
将0.2mol/L的NaOH溶液和0.4mol/L的NH4Cl溶液等体积混合,混合溶液中粒子浓度从大到小的排列顺序为 .
考点:离子浓度大小的比较
专题:
分析:NaOH和NH4Cl反应方程式为NaOH+NH4Cl=NH3.H2O+NaCl,NH4Cl溶液浓度是NaOH溶液浓度的2倍,二者等体积混合,根据方程式知,NH4Cl有一半剩余,则溶液中的溶质为等物质的量浓度的NH4Cl、NH3.H2O、NaCl,NH4Cl中铵根离子水解程度小于NH3.H2O电离程度,导致溶液出碱性,根据电荷守恒、物料守恒判断溶液中离子浓度大小.
解答:
解:NaOH和NH4Cl反应方程式为NaOH+NH4Cl=NH3.H2O+NaCl,NH4Cl溶液浓度是NaOH溶液浓度的2倍,二者等体积混合,根据方程式知,NH4Cl有一半剩余,则溶液中的溶质为等物质的量浓度的NH4Cl、NH3.H2O、NaCl,NH4Cl中铵根离子水解程度小于NH3.H2O电离程度,导致溶液出碱性,则c(OH-)>c(H+),氯离子、钠离子不水解,结合物料守恒知c(Cl-)最大,c(NH4+)>c(Na+),NH3.H2O是弱电解质,电离程度较小,所以溶液中粒子浓度大小顺序是c(Cl-)>(NH4+)>c(Na+)>c(NH3.H2O)>c(OH-)>c(H+),
故答案为:c(Cl-)>(NH4+)>c(Na+)>c(NH3.H2O)>c(OH-)>c(H+).
故答案为:c(Cl-)>(NH4+)>c(Na+)>c(NH3.H2O)>c(OH-)>c(H+).
点评:本题考查离子浓度大小比较,明确溶液中的溶质及溶液酸碱性是解本题关键,再结合守恒思想分析解答,注意一水合氨和钠离子浓度之间的关系,题目难度中等.

练习册系列答案
相关题目
溶液、胶体、浊液这三种分散系的本质区别是( )
| A、分散质粒子大小不同 |
| B、稳定性不同 |
| C、是否具有丁达尔效应 |
| D、能否透过滤纸 |
下列反应中,属于非氧化还原反应的是( )
| A、3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O |
| B、3Cl2+6KOH═5KCl+KClO3+3H2O |
| C、Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O |
| D、CuCl2+Ba(OH)2═Cu(OH)3↓+BaCl2 |
常温下,下列各组离子一定能大量共存的是( )
| A、滴加石蕊显红色的溶液中:Na+、Fe2+、Cl-、NO3- | ||
B、
| ||
| C、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- | ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
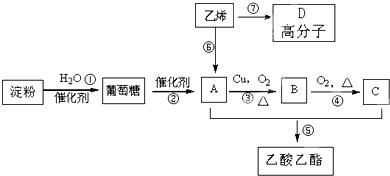
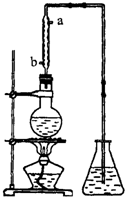 久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应:
久置的乙醛水溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的环状聚合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基,乙醛的沸点是20.8℃,它在溶液中易被氧化,氧化产物的沸点是117.9℃,从久置的乙醛水溶液中提取乙醛(仍得到乙醛水溶液),可利用如下反应: