题目内容
10.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )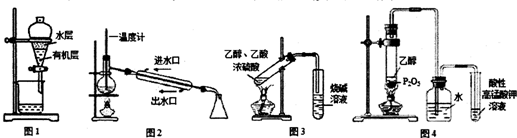
| A. | 用图1所示装置分离用苯萃取碘水后已分层的有机层和水层 | |
| B. | 用图2所示装置进行石油的分馏 | |
| C. | 用图3所示装置制备少量的乙酸乙酯 | |
| D. | 用图4所示装置制取乙烯并验证其易被氧化 |
分析 A.苯的密度比水小,分层后在上层;
B.冷凝管中水应该从下口流入上口流出;
C.乙酸乙酯在NaOH溶液中水解;
D.乙醇挥发后溶解在水中,排除对乙烯检验的干扰.
解答 解:A.苯的密度比水小,分层后在上层,与图中装置分层现象不符,故A错误;
B.冷凝管中水应该从下口流入上口流出,否则易炸裂冷凝管,故B错误;
C.乙酸乙酯在NaOH溶液中水解,应在试管中盛放饱和碳酸钠溶液,故C错误;
D.乙醇挥发后溶解在水中,排除对乙烯检验的干扰,则图中装置能制取乙烯并验证其易被氧化,故D正确.
故选D.
点评 本题考查化学实验方案的评价,涉及物质的除杂、混合物的分离提纯、气体的制取等,把握物质的性质及实验装置的作用为解答的关键,选项C为易错点,题目难度不大.

练习册系列答案
相关题目
20.若NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 4.6gNa在空气中完全燃烧,反应中转移电子数为0.2NA | |
| B. | 100mL0.lmol/L氨水中含有NH3•H2O分子数为0.01NA | |
| C. | 常温常压下3.36LCO2中含有氧原子数为0.3NA | |
| D. | 1molFe与过量的稀HNO3反应,转移2NA个电子 |
1.在体育锻炼中,消耗的能量主要来自于( )
| A. | 维生素 | B. | 蛋白质 | C. | 葡萄糖 | D. | 脂肪 |
18.根据下列化学方程式:①2MnO4-+16H++10Cl-=2Mn2+十8H2O十5Cl2↑
②2Fe2++Cl2=2Fe3++2Cl-
③2Fe3++Cu=2Fe2++Cu2+
④Fe+Cu2+=Fe2++Cu
可推断MnO4-、Fe2+、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为( )
②2Fe2++Cl2=2Fe3++2Cl-
③2Fe3++Cu=2Fe2++Cu2+
④Fe+Cu2+=Fe2++Cu
可推断MnO4-、Fe2+、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为( )
| A. | MnO4-.>Cl2>Fe3+>Cu2+>Fe2+ | B. | Fe3+>MnO4->Cl2>Cu2+>Fe2+ | ||
| C. | Cl2>MnO4->Fe3+>Cu2+>Fe2+ | D. | Cu2+>Cl2>MnO4->Fe3+>Fe2+ |
5.氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )
| A. | HCN既是氧化剂又是还原剂 | B. | CaCN2中含有非极性键 | ||
| C. | CO为氧化产物,H2为还原产物 | D. | 每消耗5g CaCO3生成1.12L CO2 |
2.下列说法正确的是( )
| A. | 用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 | |
| B. | 因为SO2有漂白性,所以它可使紫色石蕊溶液褪色 | |
| C. | 氯化钠溶液在电流作用下电离成Na+离子和Cl-离子 | |
| D. | 等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸钠产生的CO2多 |
3.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| A. | 冰水共存物、空气、氨水、二氧化硫 | B. | 胆矾、盐酸、硫酸钠、干冰 | ||
| C. | 生铁、福尔马林、浓硫酸、碳酸钙 | D. | 碱石灰、漂白粉、氧化钠、硫酸钡 |
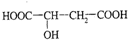 .
.

 ,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.
,反应A的热化学方程式是4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6 KJ/mol.