题目内容
6.NA表示阿伏加德罗常数的值,下列说法错误的是( )| A. | -定量的Fe与含1molHNO3,的稀硝酸恰好反应,被还原的氮原子数小于NA | |
| B. | 1mol A1Cl3在熔融时离子总数为0.4NA | |
| C. | 常温常压下,等质量的S02、S2含有相同的分子数 | |
| D. | 125g CuS04•5H20 品体中含有0.5NA个Cu2+ |
分析 A、硝酸与铁反应时,硝酸既做氧化剂又做酸;
B、氯化铝为共价化合物;
C、S02、S2的摩尔质量相同;
D、求出五水硫酸铜的物质的量,然后根据1mol五水硫酸铜中含1mol铜离子来分析.
解答 解:A、硝酸与铁反应时,硝酸既做氧化剂又做酸,故当硝酸共1mol时,被还原的硝酸一定小于1mol,即被还原的氮原子数小于NA个,故A正确;
B、氯化铝为共价化合物,而共价键在熔融时不能电离,故1mol氯化铝在熔融时无离子,故B错误;
C、S02、S2的摩尔质量相同,故等质量的两者的物质的量相同,则分子个数相同,故C正确;
D、125g五水硫酸铜的物质的量为0.5mol,而1mol五水硫酸铜中含1mol铜离子,故0.5mol五水硫酸铜中含0.5mol铜离子即0.5NA个,故D正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.分析如图的能量变化示意图,确定下列选项中正确的是( )


| A. | A2(g)+B2(g)=2AB(g)△H<0 | |
| B. | 每生成2分子AB放出bkJ热量 | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 断裂1molA-A键吸收akJ能量 |
14.下列反应的离子方程式中,正确 的是( )
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铁跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 钠和冷水反应:2Na+2H2O=═2Na++2OH-+H2↑ | |
| D. | FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- |
1.下列说法或表示方法正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ | |
| C. | 由C(石墨)=C(金刚石);△H=+1.90 kJ/mol可知,金刚石比石墨稳定 | |
| D. | 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
11.“84消毒液”,能有效杀灭甲型H7N9病毒,某同学参阅“84消毒液”,说明中的配方,欲用NaClO固体自己配制480mL含NaCl0 25%.密度为1.2g•cm -3的消毒液,下列说法正确的是( )

| A. | 需要称量NaClO固体的质量为144.0g | |
| B. | 定容摇匀后,若溶液液面低于容量瓶刻度线.不必再加水定容 | |
| C. | 除从如图所示的仪器中选择需要的以外.还-种玻填仪器 | |
| D. | 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制.否則结果偏低 |
18.化学知识与生活密切相关.生活中的下列做法用到物质氧化性的是( )
| A. | 明矾净化水 | B. | 纯碱除去油污 | C. | 食醋清洗水垢 | D. | 臭氧消毒餐具 |
15.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图1表示200℃时容器中A、B、C物质的量随时间的变化关系,图2表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
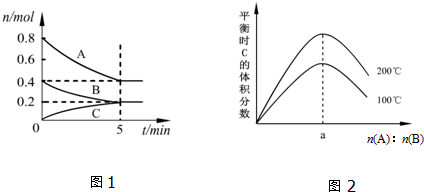

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图2所知反应xA(g)+yB(g)?zC(g)的△H>0,且a=2 | |
| C. | 若在图1所示的平衡状态下,再向体系中充入He,此时v正>v逆 | |
| D. | 200℃时,向容器中充入1.6molA和0.8molB,达到平衡时,A的转化率大于50% |
16.化学与生活、社会密切相关.下列说法不正确的是( )
| A. | 高铁酸盐(含FeO42-离子)是新型、高效、多功能水处理剂,既能消毒杀菌又能净水 | |
| B. | 用硫酸清洗锅炉中的水垢 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 使用Na2S作沉淀剂,可有效除去废水中Cu2+和Hg2+ |