题目内容
运用化学反应原理研究NH3的性质具有重要意义.回答下列问题:
(1)已知①4NH3(g)+3O2(g)=2N2(g)+6H20(g)△H=-1266.8kJ/mol②N2(g)+O2(g)=2N0(g)△H=+180.5kJ/mol写出氨高温催化氧化的热化学方程式:
(2)氨气、空气可以构成碱性燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.则负极的电极反应式为: .
(3)恒容密闭容器中,合成氨反应3H2(g)+N2(g)
2NH3(g)的平衡常数K值和温度的关系如下:
①由上表数据可知,该反应为 反应(“吸热”或“放热”)
②理论上,为了增大平衡时H2的转化率,可采取的措施是 (填字母序号)
a.增大压强 b.增大氢气浓度 c.升高温度 d.及时分离出产物中的氨
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol/L、2mol/L、1mol/L时,该反应的v(正) v(逆)(填“>”、“=”或“<”).
(4)25℃时,将pH=3的盐酸和pH=11的氨水等体积混合,溶液中离子浓度由大到小的顺序为: .
(1)已知①4NH3(g)+3O2(g)=2N2(g)+6H20(g)△H=-1266.8kJ/mol②N2(g)+O2(g)=2N0(g)△H=+180.5kJ/mol写出氨高温催化氧化的热化学方程式:
(2)氨气、空气可以构成碱性燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.则负极的电极反应式为:
(3)恒容密闭容器中,合成氨反应3H2(g)+N2(g)
| 高温、高压 |
| 催化剂 |
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是
a.增大压强 b.增大氢气浓度 c.升高温度 d.及时分离出产物中的氨
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol/L、2mol/L、1mol/L时,该反应的v(正)
(4)25℃时,将pH=3的盐酸和pH=11的氨水等体积混合,溶液中离子浓度由大到小的顺序为:
考点:化学平衡的计算,热化学方程式,原电池和电解池的工作原理,离子浓度大小的比较
专题:
分析:(1)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g);△H=-1266.8kJ/mol;②N2(g)+O2(g)═2NO(g);△H=+180.5kJ/mol,利用盖斯定律可求知反应热;
(2)负极发生氧化反应;
(3)①分析平衡常数随温度变化结合平衡移动原理判断;
②为了增大平衡时H2的转化率,平衡正向进行分析选项;
③依据浓度商和平衡常数比较得到反应进行的方向;
(4)pH=3的盐酸和pH=11的氨水等体积混合,体系为NH4Cl溶液和NH3.H2O,氨水过量较多,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
(2)负极发生氧化反应;
(3)①分析平衡常数随温度变化结合平衡移动原理判断;
②为了增大平衡时H2的转化率,平衡正向进行分析选项;
③依据浓度商和平衡常数比较得到反应进行的方向;
(4)pH=3的盐酸和pH=11的氨水等体积混合,体系为NH4Cl溶液和NH3.H2O,氨水过量较多,溶液呈碱性:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
解答:
解:(1)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ/mol,
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)
4NO(g)+6H2O(g);△H=-905.8KJ/mol,
故答案为:4NH3(g)+5O2(g)
4NO(g)+6H2O(g);△H=-905.8KJ/mol;
(2)负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
(3)①图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应;
故答案为:放热;
②反应是N2+3H2
2NH3,反应是气体体积减小的放热反应,为了增大平衡时H2的转化率,平衡正向进行分析,
a.增大压强,平衡正向进行,氢气转化率增大,故a符合;
b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;
c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;
d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;
故答案为:ad;
③Qc=
=4.5>K=0.5,说明反应向逆反应方向进行,因此v正(N2)<v逆(N2),
故答案为:<;
(4)pH=3的盐酸和pH=11的氨水等体积混合,体系为NH4Cl溶液和NH3.H2O,氨水过量较多,溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+);故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)
| ||
| △ |
故答案为:4NH3(g)+5O2(g)
| ||
| △ |
(2)负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O;
(3)①图表中平衡常数随温度升高减小,说明平衡逆向进行,逆向是吸热反应,正向是放热反应;
故答案为:放热;
②反应是N2+3H2
| ||
| 高温高压 |
a.增大压强,平衡正向进行,氢气转化率增大,故a符合;
b.使用合适的催化剂,改变反应速率,不能改变平衡,氢气转化率不变,故b不符合;
c.升高温度平衡逆向进行,氢气转化率减小,故c不符合;
d.及时分离出产物中的NH3,平衡正向进行,氢气转化率增大,故d符合;
故答案为:ad;
③Qc=
| 3 2 |
| 2×1 3 |
故答案为:<;
(4)pH=3的盐酸和pH=11的氨水等体积混合,体系为NH4Cl溶液和NH3.H2O,氨水过量较多,溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+);故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
点评:本题考查了反应热的计算、燃料电池电极反应式的书写、化学平衡问题、离子浓度大小的比较,综合性很强,明确溶液中的溶质是离子浓度大小比较的基础,注意结合电荷守恒来分析解答.

练习册系列答案
相关题目
由如图分析,有关叙述正确的是( )
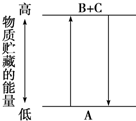

| A、A-→B+C和B+C-→A两个反应吸收或放出的能量不等 |
| B、A-→B+C是放热反应 |
| C、A具有的能量高于B和C具有的能量总和 |
| D、A-→B+C是吸热反应,则B+C-→A必然是放热反应 |
下列各组离子中,在溶液中能大量共存 的是( )
| A、Na+、Ca2+、CO32- |
| B、Na+、Ca2+、HCO3- |
| C、H+、SO42-、OH- |
| D、H+、Na+、CO32- |
用盐酸测定碳酸钠时既可用酚酞作指示剂又可用甲基橙(一种酸碱指示剂)作指示剂,现分别用酚酞和甲基橙作指示剂,用0.1000mol/L的HCl滴定20.00mL的纯碱溶液,滴定终点时分别用去了20.00mL、40.00mL的盐酸,下列说法中不正确的是( )
| A、用酚酞作指示剂时滴定的总反应为:Na2CO3+HCl═NaHCO3+NaCl |
| B、用甲基橙作指示剂时滴定的总反应为:Na2CO3+2HCl═NaCl+CO2↑+H2O |
| C、可用碱式滴定管量取所需要的Na2CO3溶液 |
| D、若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏低 |
在一定温度下向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应X(g)+Y(g)?2Z(g),此反应达到平衡的标志是( )
| A、容器内压强不随时间变化 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:1:2 |
| D、单位时间内消耗0.1 mol X同时生成0.2 mol Z |