题目内容
16.反应X(g)+Y(g)?2Z(g)△H<0,达到平衡时,下列说法正确的是( )| A. | 增大c(X),X的转化率增大 | B. | 降低温度,Y的转化率增大 | ||
| C. | 减小容器体积,平衡向右移动 | D. | 加入催化剂,Z的产率增大 |
分析 A、两种反应物,增加一种物质的量增大另一种物质转化率,本身转化率减小;
B、反应是放热反应,降温平衡正向进行;
C、反应前后气体体积不变,减小容器体积压强增大,平衡不变;
D、催化剂改变反应速率,不改变化学平衡.
解答 解:A、两种反应物,增加一种物质的量增大另一种物质转化率,本身转化率减小,增大c(X),X的转化率减小,故A错误;
B、反应是放热反应,降温平衡正向进行,Y的转化率增大,故B正确;
C、反应前后气体体积不变,减小容器体积压强增大,平衡不变,故C错误;
D、催化剂改变反应速率,不改变化学平衡,Z的产率不变,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素分析判断和化学平衡移动的理解应用,题目难度中等.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
6.下列说法中正确的是( )
| A. | 用完的电池可以随意地丢弃 | |
| B. | 增加炼铁高炉的高度可以降低尾气中CO的含量 | |
| C. | 实验室用一定质量的锌和过量的稀硫酸反应制取氢气时,加入少量硫酸铜可以加快反应速率且生成氢气的量不变 | |
| D. | 把煤粉碎后再燃烧可以提高煤的燃烧效率 |
7.下列有关实验的说法中错误的是( )
| A. | 石蜡油分解产物中含有烯烃 | |
| B. | 直接蒸馏含杂质的工业乙醇不能得到无水乙醇 | |
| C. | 实验室用苯和溴水在溴化铁催化作用下制取溴苯 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应制取硝基苯 |
8.用括号中的试剂除去各组中的杂质,正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 95.6%乙醇中的水(CaO) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 溴苯中的溴(苯) |
 ;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O.
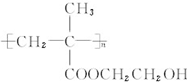 .
.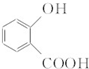 和CH3COOH(写结构简式).
和CH3COOH(写结构简式). 互为同系物且一氯代物只有两种的物质的结构简式:
互为同系物且一氯代物只有两种的物质的结构简式: 或
或 .
.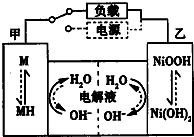 近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.
近期因“召回门”而闹得沸沸扬扬的丰田Prius属于第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态.