题目内容
3.四氯化锡(SnCl4)是一种重要的化工产品.某化学实验小组设计如下装置制备SnCl4.
已知:①金属锡熔点231℃,化学活泼性与铁相似;
②干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114℃;
③SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化.
(1)试管Ⅱ中的试剂是饱和食盐水.
(2)Ⅵ处装置最好选用C(填序号).

(3)实验结束后,欲回收利用装置I中未反应完的MnO2,需要的玻璃仪器有普通漏斗、玻璃棒、烧杯
(4)甲同学认为V中产品可能含有SnCl2,请利用所给试剂设计实验,检测产品中是否存在SnCl2,简要说明实验操作和现象:取适量溴的四氯化碳溶液向其中加入足量的产品振荡,溶液颜色褪去
,则证明含有SnCl2,否则不含.
已知:MnO4的氧化性强于氯气
供选择的试剂:FeCl2溶液、酸性KmnO4溶液、稀盐酸、Br2的四氯化碳溶液
(5)实验用锡粒中含有杂质Cu.乙同学设计下列实验测定锡粒的纯度.
第一步:称取7.5g锡粒溶入足量稀盐酸中;
第二步:加入过量FeCl3,将Sn2+氧化成Sn4+;
第三步:用1mol•L-1K2Cr2O7溶液滴定生成的Fe2+,发生反应的表达式为(未配平):
Fe2++Cr2O72-+H+→Cr3++Fe3++H2O
第二步中发生反应的离子方程式是2Fe3++Sn2+=2Fe2++Sn4+,
若达到滴定终点时共消耗20mLK2Cr2O7溶液,试计算锡粒中锡的百分含量95.2%.
分析 (1)分析装置Ⅰ是制备氯气的发生装置,生成的氯气中含有氯化氢和水蒸气,需要除杂,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,进入装置Ⅳ和锡反应生成SnCl4、试管Ⅱ中的试剂是饱和食盐水,
故答案为:饱和食盐水;
(2)SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化,应避免空气中成分进入装置Ⅴ;
(3)回收利用装置I中未反应完的MnO2,二氧化锰难溶于水用过滤操作回收,结合过滤装置选择需要的仪器;
(4)甲同学认为V中产品可能含有SnCl2,检测产品中是否存在SnCl2,可以利用其还原性设计实验验证;
(5)过量FeCl3,将Sn2+氧化成Sn4+,本身被还原为亚铁离子,结合原子守恒和电荷守恒写出离子方程式;根据n=cV计算反应中消耗的K2Cr2O7的物质的量;根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,据此计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量.
解答 解:(1)分析装置Ⅰ是制备氯气的发生装置,生成的氯气中含有氯化氢和水蒸气,需要除杂,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,进入装置Ⅳ和锡反应生成SnCl4,故答案为:饱和食盐水;
(2)SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化,应避免空气中成分进入装置Ⅴ,
A装置可以吸收剩余气体,但不能保证水蒸气进入装置Ⅴ,B装置不能吸收剩余氯气,装置C可以吸收水蒸气和二氧化碳,能避免空气中二氧化碳和水蒸气进入装置Ⅴ,故选C,
故答案为:C;
(3)回收利用装置I中未反应完的MnO2,二氧化锰难溶于水用过滤操作回收,结合过滤装置选择需要的仪器为:普通漏斗、玻璃棒、烧杯,
故答案为:普通漏斗、玻璃棒、烧杯;
(4)甲同学认为V中产品可能含有SnCl2,检测产品中是否存在SnCl2,可以利用其还原性设计实验验证,取适量溴的四氯化碳溶液向其中加入足量的产品振荡,溶液颜色褪去,则证明含有SnCl2,否则不含,
故答案为:取适量溴的四氯化碳溶液向其中加入足量的产品振荡,溶液颜色褪去;
(5)第二步:过量FeCl3,将Sn2+氧化成Sn4+,本身被还原为亚铁离子,反应的离子方程式为:2Fe3++Sn2+=2Fe2++Sn4+,反应中消耗的K2Cr2O7的物质的量为1.0mol/L×0.020L=0.02mol,
根据方程式可得关系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,
故n(Sn)=3n(K2Cr2O7)=3×0.02mol=0.06mol,
Sn的质量为:0.06mol×119g/mol=7.14g,
试样中Sn的百分含量为$\frac{7.14g}{7.5g}$×100%=95.2%,
故答案为:2Fe3++Sn2+=2Fe2++Sn4+;95.2%.
点评 本题考查实验探究和物质制备方法和过程分析,氧化还原反应滴定的计算,难度中等,注意利用关系式计算的计算.

| A. | >100 mL | B. | =100 mL | C. | <100 mL | D. | 不能确定 |
| A. | 增大压强一定能加快化学反应速率 | |
| B. | 使用催化剂,使反应的活化能降低,反应速率加快,平衡右移 | |
| C. | 减小反应物浓度可以减小化学反应速率常数,从而减小化学反应速率 | |
| D. | 升高温度,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快 |

 ,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)
,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”) 氯乙烷跟化合物之间的转化如图所示:
氯乙烷跟化合物之间的转化如图所示:
 工业设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到了宝贵的能源物质.为了探究反应原理,先进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到了宝贵的能源物质.为了探究反应原理,先进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.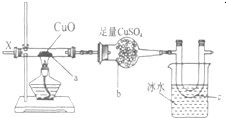 按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )
按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )