题目内容
6.物质结构包括原子结构、分子结构及晶体结构,物质结构决定了物质的性质.(1)下列说法中正确的是AD.
A.半径:O2->Na+>Mg2+
B.含氧酸的酸性:Cl>S>P
C.简单氢化物的稳定性:N>O>F D.熔点:金刚石>碳化硅>硅单质
(2)C、N、O的电负性由大到小的顺序为O>N>C.Na、Mg、Al的第一电离能由大到小的顺序为Mg>Al>Na.
(3)乙酸分子中σ键与π键的数目比为7:1.HCOOCH3是乙酸的一种同分异构体,但沸点却比乙酸低得多,原因是乙酸分子间能形成氢键.
(4)已知AlC13在178℃升华,熔融时生成二聚体Al2Cl6(结构式如下).

电解法制铝的原料是熔融的A12O3而不是AlC13,原因是AlCl3为分子晶体,熔融时不能电离;电解法制镁的原料是熔融的MgCl2而不用MgO,原因是MgO的晶格能大,熔点高,熔融时需要的能量多.
分析 (1)A.离子结构相同时,质子数越大,半径越小;
B.非金属的含氧酸需要考虑价态的变化;
C.元素的非金属性越强,对应的氢化物越稳定;
D.均为原子晶体,共价键越短,键能越大,熔点越高;
(2)同周期主族元素,越往右,电负性越大;同周期主族元素第一电离能越往后呈现增大的趋势,但IIA族>IIIA族;
(3)乙酸分子为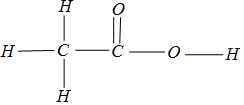 ,双键中有一根σ键,一根π键;HCOOCH3是乙酸的一种同分异构体,但沸点却比乙酸低得多,考虑分子间氢键的影响;
,双键中有一根σ键,一根π键;HCOOCH3是乙酸的一种同分异构体,但沸点却比乙酸低得多,考虑分子间氢键的影响;
(4)AlCl3为共价化合物,178℃左右升华,温度较低,是分子晶体;MgO的晶格能较大,电解时耗能多.
解答 解:(1)A.离子结构相同时,质子数越大,半径越小,因此顺序为O2->Na+>Mg2+,故A正确;
B.对于非金属的含氧酸,需要考虑多个价态,在同一价态时的含氧酸比较具有意义,故B错误;
C.元素的非金属性越强,对应的氢化物越稳定,顺序应为:F>O>N,故C错误;
D.均为原子晶体,共价键越短,键能越大,熔点越高,则熔点:金刚石>碳化硅>硅单质,故D正确.
故选AD;
(2)同周期主族元素,越往右,电负性越大,则电负性顺序为:O>N>C;同周期主族元素第一电离能越往后呈现增大的趋势,但IIA族>IIIA族,则第一电离能顺序为:Mg>Al>Na,
故答案为:O>N>C;Mg>Al>Na;
(3)乙酸分子为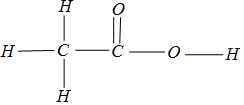 ,对于双键,双键中有一根σ键,一根π键,单键均为σ键,则一个乙酸分子中,σ键数目有7,π键数目为1,则乙酸分子中σ键与π键的数目比为7:1;HCOOCH3是乙酸的一种同分异构体,但沸点却比乙酸低得多,是由于乙酸分子间能形成分子间氢键,导致其沸点增大,
,对于双键,双键中有一根σ键,一根π键,单键均为σ键,则一个乙酸分子中,σ键数目有7,π键数目为1,则乙酸分子中σ键与π键的数目比为7:1;HCOOCH3是乙酸的一种同分异构体,但沸点却比乙酸低得多,是由于乙酸分子间能形成分子间氢键,导致其沸点增大,
故答案为:7:1;乙酸分子间能形成氢键;
(4)AlCl3在170℃左右升华,气态为二聚体,此温度较低,应为分子晶体,电解法制铝的原料是熔融的A12O3而不是AlCl3,则就是由于AlCl3在熔融时不发生电离;电解法制镁的原料是熔融的MgCl2而不用MgO,则是由于MgO的高晶格能,导致其熔点大,电解MgO相比较而言耗能更大,
故答案为:AlCl3为分子晶体,熔融时不能电离,MgO的晶格能大,熔点高,熔融时需要的能量多.
点评 本题考查物质结构相关知识,包含电负性,电离能的比较,价键类型的判断,元素周期律的知识,以及电解原理.题目考查较综合,难度不大,是基础题.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | Y的简单气态氢化物的沸点高于同族相邻元素的简单气态氢化物 | |
| B. | Z与X形成的化合物,既能溶于盐酸又能溶于氨水 | |
| C. | W与Y元素形成的化合物既含离子键又含共价键 | |
| D. | X和Y的单质常温下就很容易发生反应 |
 某有机物的结构如图所示,这种有机物可能具有的性质是( )
某有机物的结构如图所示,这种有机物可能具有的性质是( )①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加成反应;
⑥能发生水解反应.
| A. | ①②③④⑥ | B. | ②③④ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
| A. | 二氧化硫可广泛用于食品的增白 | |
| B. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| C. | 用浸有KMnO4溶液的硅土来吸收水果释放的乙烯 | |
| D. | 糖尿病人应少吃含糖类的食品,可常喝糯米八宝粥 |
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>l一氯丁烷 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 用Na2CO3溶液不能区分CH3COOH 和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 |
| A. | X的非金属性比Y弱 | |
| B. | X的原子序数比Y的大 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | X的最高价氧化物对应的水化物的酸性比Y的最高价氧化物对应水化物的酸性弱 |
| A. | 原子序数为15的元素的最高化合价为+3 | |
| B. | ⅦA族元素是同周期中非金属性最强的元素 | |
| C. | 第二周ⅣA族元素的原子核电荷数和中子数一定为6 | |
| D. | IA族元素的金属性一定比ⅡA族元素的金属性强 |
| A. | 苯、溴苯、四氯化碳 | B. | 苯、乙醇、四氯化碳 | ||
| C. | 苯、乙醇、乙酸 | D. | 苯、乙酸乙酯、己烷 |
 (1)写出基态镍原子的价电子排布图
(1)写出基态镍原子的价电子排布图 .
. )分子中2号碳原子的杂化方式为sp2杂化;与CS2互为等电子体的离子是SCN-(写一种).
)分子中2号碳原子的杂化方式为sp2杂化;与CS2互为等电子体的离子是SCN-(写一种).